Nature子刊:呈源生物陈曦等开发高通量、个性化TCR发现技术,增强实体瘤细胞治疗潜力
来源:生物世界 2024-04-25 09:31
研究团队利用该技术筛选了来自多个癌症患者的数千个肿瘤浸润淋巴细胞(TIL)来源的TCR,并鉴定了数十个具有强大肿瘤反应性的CD4+和CD8+ T细胞来源的TCR,包括识别患者特异性新抗原的TCR。
T细胞受体(TCR)基因治疗是一种有效的细胞免疫治疗形式,来自癌症患者的T细胞在体外进行基因工程改造,以表达具有明确肿瘤反应性的TCR,然后再输回患者体内。然而,由于患者T细胞谱中肿瘤特异性T细胞的普遍稀缺以及肿瘤上表达的T细胞表位的患者特异性,治疗性TCR的发现和识别变得复杂。
2024年4月23日,呈源生物陈曦、Ely Porter、荷兰癌症研究所Wouter Scheper等人在 Nature Biotechnology 期刊发表了题为:Discovery of tumor-reactive T cell receptors by massively parallel library synthesis and screening 的研究论文。
该研究开发了一种高通量、个性化的T细胞受体(TCR)发现新技术,将大规模合成TCR文库的组装与高通量遗传筛选相结合,从而在单次实验中筛选并发现肿瘤反应性TCR,大幅降低TCR发现所需时间,有望成为设计细胞免疫疗法的有力工具。

T细胞受体(TCR)基因疗法是细胞免疫疗法的一种形式,将癌症患者的外周血T细胞在体外经过肿瘤特异性TCR的基因工程改造,然后再输回患者体内。与其他免疫疗法(免疫检查点阻断疗法或肿瘤浸润淋巴细胞疗法)相比,治疗性TCR的遗传转移能够完全控制工程T细胞应答的特异性,而T细胞应答严格依赖于所选择的TCR。此外,体外构建的TCR基因工程T细胞允许额外的基因修饰,从而使基因工程T细胞在体内具有最大的活性和持久性。
然而,在许多患者中,肿瘤特异性TCR仅占外周或肿瘤内TCR库的一小部分,这一事实使患者来源的、与治疗相关的TCR的识别变得复杂。此外,许多最具免疫原性的肿瘤抗原,例如由患者特异性肿瘤突变产生的癌症新抗原(neoantigen),对个体患者是独特的,这凸显出在发现治疗性TCR时需要真正的个性化技术。
虽然主要组织相容性复合体MHC-I类限制性CD4+ T细胞在抗肿瘤免疫中的作用已经明确,但最近的数据强调了MHC-II类限制性CD4+T细胞通过直接抗肿瘤细胞毒性和增强肿瘤特异性CD8+ T细胞的活性,在肿瘤控制和对免疫治疗应答中发挥重要作用。因此,我们需要能够在患者个体层面上高通量地发现MHC-I和MHC-II限制性TCR的新技术。
在这项研究中,研究团队开发了一种高通量、个性化的TCR发现新技术,将大规模合成TCR文库的组装与高通量遗传筛选相结合,从而在单次实验中能够对数千个个体TCR的特异性进行功能分析。值得注意的是,通过生成患者来源的TCR合成库,该方法允许以不受患者体内T细胞表型适应性和克隆丰度影响的方式评估TCR特异性。
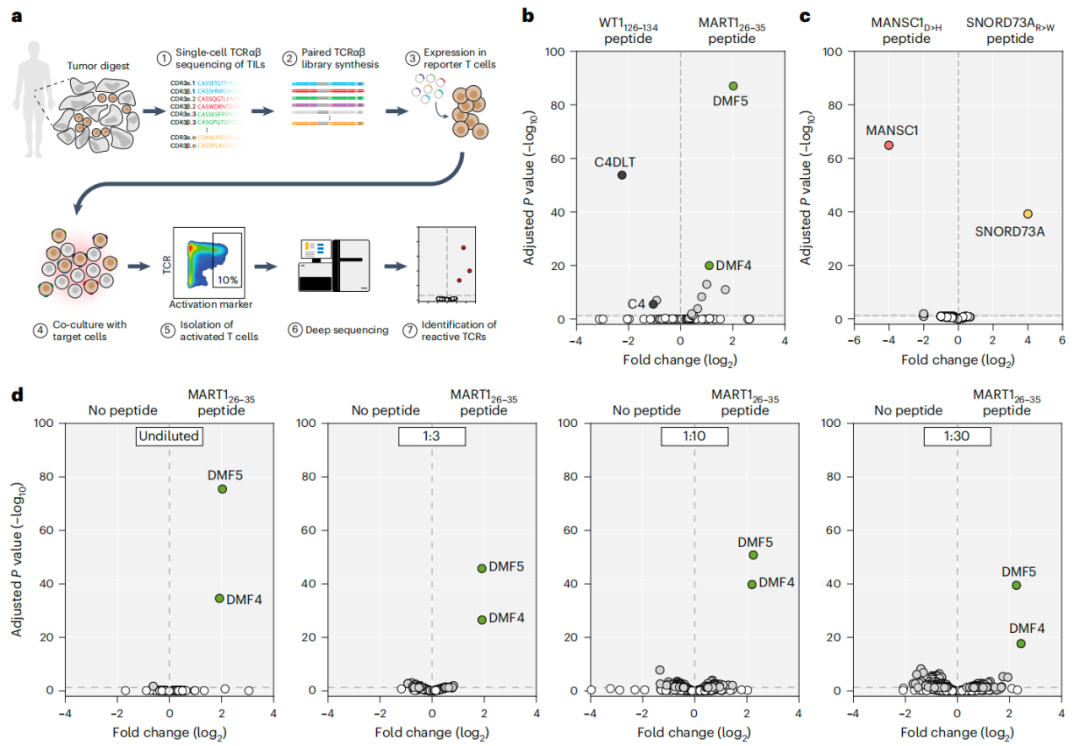
合成TCR文库的大规模功能分析概述与验证
研究团队利用该技术筛选了来自多个癌症患者的数千个肿瘤浸润淋巴细胞(TIL)来源的TCR,并鉴定了数十个具有强大肿瘤反应性的CD4+和CD8+ T细胞来源的TCR,包括识别患者特异性新抗原的TCR。
研究团队表示,该方法有助于识别肿瘤抗原特异性TCR,用于下一代个性化TCR基因疗法。通过精心优化的、符合良好实验室规范(GLP)的工作流程,预计使用该技术将在4-5周内(从患者组织入组到验证TCR)实现治疗性TCR的发现,而现有的TCR或肿瘤抗原的发现可能需要3-5个月之久。因此,该研究提出的方法是将来设计细胞免疫疗法的有力工具。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


