Nature:中山大学团队老药新用,逆转肿瘤耐药
来源:网络 2024-07-07 09:45
NBS1乳酸化修饰促进DNA损伤修复及化疗抵抗,导致临床预后不良,而LDHA是这一过程的关键酶。
中山大学附属第七医院何裕隆、张常华教授团队联合中山大学孙逸仙纪念医院尹东教授、英国癌症研究院的研究人员,在" Nature "杂志上发表了一篇题为" NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance "的研究论文。
该研究揭示了乳酸通过NBS1蛋白乳酸化修饰在DNA修复和化疗耐药中的关键作用,提供对癌症治疗的新策略和新靶点。

研究团队通过蛋白质组学和代谢组学,分析新辅助化疗敏感或耐药的胃癌肿瘤组织标本,发现在耐药肿瘤组织中,糖酵解通路显著上调,乳酸水平显著上升。乳酸在小鼠PDX模型和类器官模型中能够降低化疗的抗肿瘤效果,即乳酸促进了荷瘤小鼠的化疗耐药,这表明乳酸在肿瘤耐药中扮演重要角色,但机制不明。
进一步研究发现,乳酸可以显著增强DNA同源重组修复(HRR)。肿瘤细胞在经受化疗造成DNA损伤后,乳酸能够快速修复受损的DNA,从而降低治疗效果,导致耐药发生(图1)。
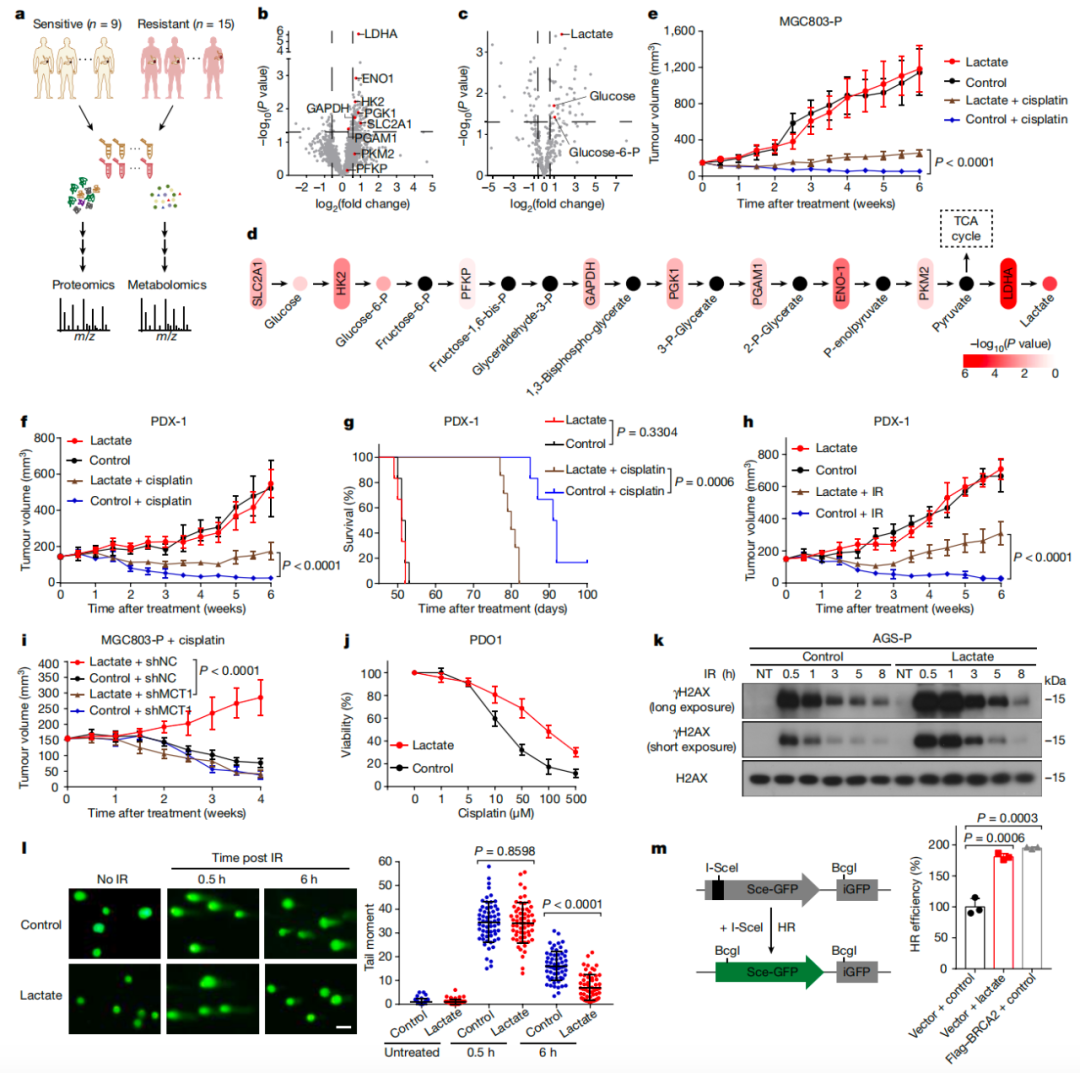
图1、乳酸增强肿瘤细胞DNA修复和肿瘤化疗耐药
接下来,研究团队探索了乳酸是否通过乳酸化修饰促进肿瘤细胞对化疗耐药。实验发现,乳酸化修饰在化疗耐药肿瘤细胞系及化疗耐药患者肿瘤组织样本中显著上调,进一步验证了乳酸化修饰在肿瘤耐药中的重要功能作用,但其调控的关键底物蛋白仍未知。研究团队使用4D-无标记乳酸化修饰蛋白质组学分析,筛选到乳酸化修饰底物蛋白为NBS1。
NBS1(Nijmegen breakage syndrome protein 1)基因,即奈梅亨断裂综合征蛋白1。NBS1突变可导致一种以染色质不稳定为特征的Nijmegen断裂综合征,主要表现为表现为生长迟缓、智力障碍、免疫缺陷、细胞周期检查点缺失、癌症风险增加以及对电离辐射敏感等。研究发现NBS1蛋白可与MRE11和RAD50蛋白形成一个MRE11-RAD50-NBS1(MRN)复合物,在DNA的复制和DNA双链断裂的修复等过程中起重要作用,主要包括DNA双链断裂部位的识别和启动HRR。乳酸化修饰质谱提示NBS1蛋白存在乳酸化修饰,且NBS1蛋白乳酸化修饰在耐药的肿瘤细胞系中显著上调。乳酸可进一步增强NBS1蛋白的乳酸化修饰。
通过乳酸化修饰质谱和免疫共沉淀等实验,研究团队鉴定并验证出NBS1蛋白上的乳酸化修饰位点位于第388位赖氨酸(K388),并开发了特异性抗体用于检测这一修饰。Co-IP质谱实验显示,乙酰基转移酶TIP60蛋白与NBS1蛋白存在相互作用。通过实验验证,TIP60被确定为NBS1的乳酸化酶,即TIP60通过直接与NBS1相互作用,乳酸化修饰NBS1蛋白。且TIP60的这一作用在乳酸和顺铂处理下显著增强。相反,组蛋白去乙酰化酶HDAC3被确定为NBS1的去乳酸化酶,通过与NBS1的相互作用去除这种修饰,抑制其乳酸化水平。这一发现通过基因编辑和体外实验得到证实,揭示了乳酸化修饰的动态调控机制(图2)。
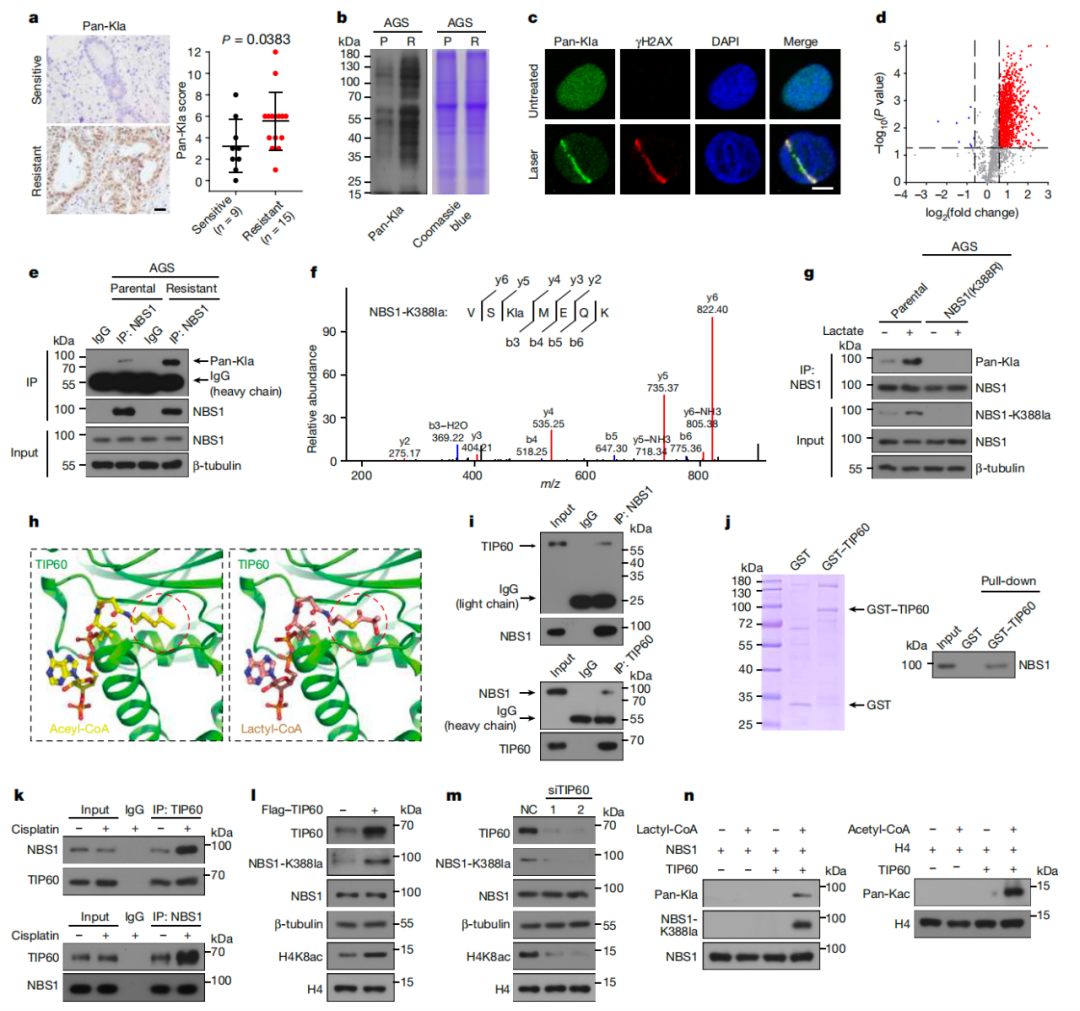
图2、乳酸诱导NBS1 K388乳酸化,TIP60介导NBS1 K388乳酸化
研究团队进一步揭示了NBS1 K388乳酸化在DNA损伤修复中的潜在作用。研究发现K388乳酸化修饰对于NBS1在DNA损伤修复中的功能至关重要。乳酸促进肿瘤耐药依赖于NBS1蛋白K388位乳酸化修饰。K388乳酸化修饰后的NBS1蛋白能够更有效地招募和组装MRN复合体,并促进HRR蛋白在DNA双链断裂部位募集,导致放化疗抵抗。深入的分子机制实验提示:乳酸化修饰是NBS1蛋白与MRE11相互作用所必须的,K388乳酸化修饰位点位于NBS1与MRE11的接触面,K388乳酸化修饰改变NBS1蛋白构象,促使NBS1蛋白和MRE11结合形成MRN复合物,MRN复合物快速募集到DNA损伤部位,增强其在DNA损伤修复中的功能(图3)。
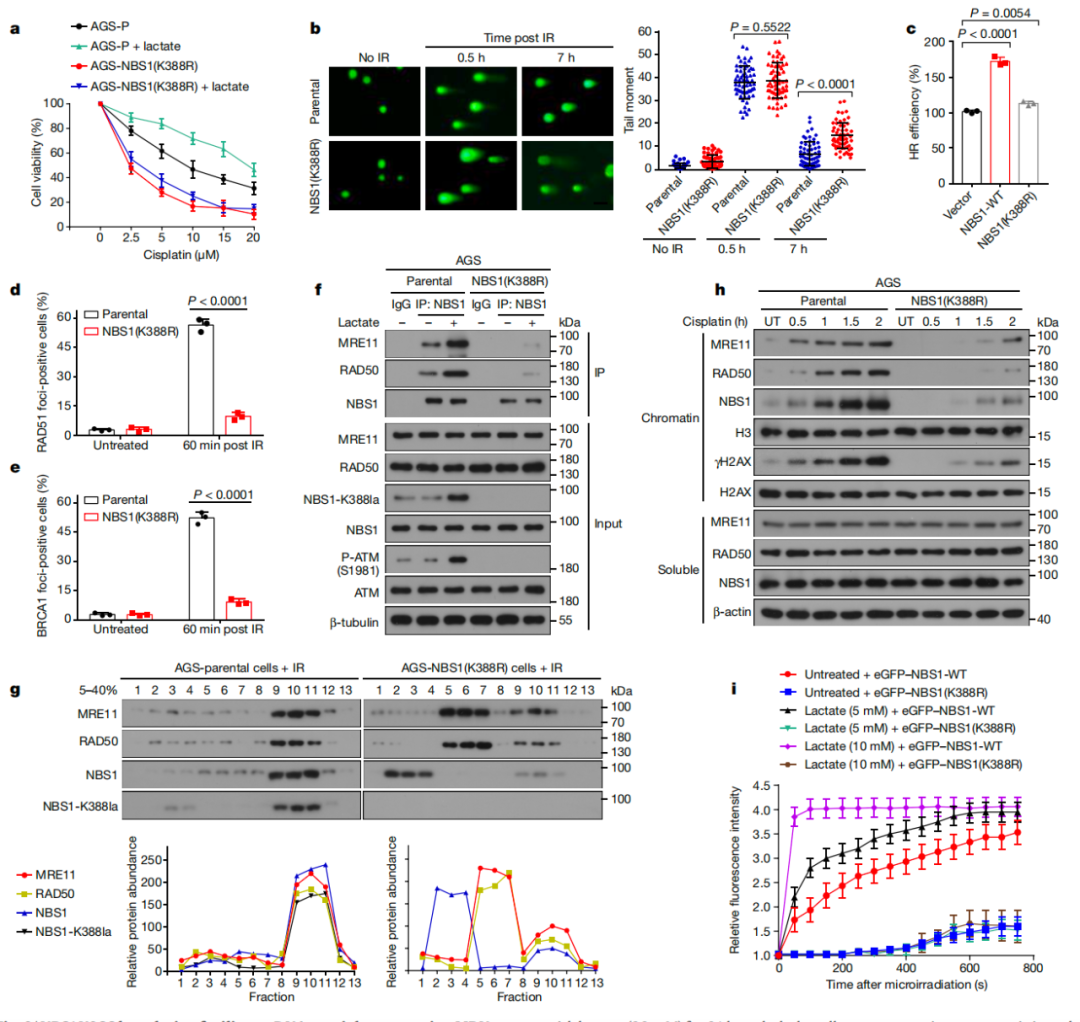
图3、NBS1 K388乳酸化通过促进MRN复合体形成促进DNA修复
然而,肿瘤细胞内的乳酸来源仍不明确。既往研究表明,肿瘤细胞中的乳酸主要有两个来源:
1、细胞内产生,由肿瘤细胞中的乳酸脱氢酶LDHA产生乳酸;
2、细胞外摄取,由定位于肿瘤细胞膜的单羧基转运蛋白MCT1将肿瘤微环境中的乳酸摄取进入细胞内。
进一步实验显示,LDHA在耐药株中高表达,而MCT1表达量无显著差异。表明肿瘤耐药细胞中的乳酸主要通过LDHA在细胞内代谢产生。进一步实验研究LDHA的生物学功能发现:LDHA促进了NBS1蛋白K388乳酸化修饰;LDHA促进DNA修复依赖于NBS1蛋白K388乳酸化修饰;LDHA和NBS1蛋白乳酸化修饰在耐药患者肿瘤中显著上调且呈正相关;LDHA高表达和NBS1蛋白乳酸化修饰高表达的提示预后不良。
综上所述,NBS1乳酸化修饰促进DNA损伤修复及化疗抵抗,导致临床预后不良,而LDHA是这一过程的关键酶。
研究团队发现靶向LDHA,抑制乳酸的产生,可以显著降低NBS1的乳酸化修饰水平,破坏肿瘤细胞的DNA修复机制。这一发现为开发新的抗癌疗法提供了新的思路,即抑制乳酸代谢、靶向LDHA能否逆转肿瘤化疗抵抗。司替戊醇(Stiripentol)是一种已被欧洲药品管理局批准用于治疗难治性癫痫的药物,是目前研究最深入的LDHA抑制剂。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


