EMBO Mol Med:通过增强机体大脑中冷休克蛋白的水平或有望治疗一系列人类神经退行性疾病
来源:生物谷原创 2023-04-10 11:46
来自柏林自由大学等机构的科学家们通过研究利用一种新型的基因疗法成功增加了小鼠大脑中所谓的“冷休克蛋白”(cold shock protein)的水平,并能保护其抵御朊病毒病所带来的潜在破坏性影响。
如今,神经退行性疾病在老年人群中越来越普遍,但目前尚无相应的治疗方法;近日,一篇发表在国际杂志EMBO Molecular Medicine上题为“ASO targeting RBM3 temperature‐controlled poison exon splicing prevents neurodegeneration in vivo”的研究报告中,来自柏林自由大学等机构的科学家们通过研究利用一种新型的基因疗法成功增加了小鼠大脑中所谓的“冷休克蛋白”(cold shock protein)的水平,并能保护其抵御朊病毒病所带来的潜在破坏性影响。这一研究发现或许是研究人员利用冷却大脑的保护性效应来治疗急性大脑损伤甚至是预防诸如阿尔兹海默病等人类痴呆症迈出的重要一步。
当机体大幅降温时就会增加名为RBM3的冷休克蛋白的水平,这种现象首次是在冬眠动物机体中观察到的;科学家们认为,在冬眠期间,这种蛋白能帮助保护大脑免于损伤并促使其继续形成新的神经元连接。早在2015年,研究者Giovanna Mallucci教授等人就通过对小鼠进行研究后发现,RBM3能保护大脑抵御与错误折叠蛋白积累相关的损伤,蛋白质的错误折叠或许会导致多种形式痴呆症的发生,比如阿尔兹海默病和帕金森疾病以及诸如克雅二氏症(CJD)等朊病毒病。
诱导性低温用于在重症监护室对患者进行治疗,包括新生儿和创伤性脑损伤患者,即让病人处于昏迷状态,这样其大脑就能被冷却从而防止损伤发生,但也会伴随出现其它风险,比如血液凝固和肺炎等,那么是否能利用冷休克蛋白来治疗病人而不必冷却机体,从而就能为急性脑损伤患者提供更为安全的疗法,或能保护大脑抵御痴呆症呢?这项研究中,研究人员研究了是否名为反义寡核苷酸(ASOs,antisense oligonucleotides)的基因疗法形式能增加小鼠大脑中冷休克蛋白的水平从而保护其大脑免于损伤。
研究人员分析了能编码冷休克蛋白产生的特殊基因,结果发现,其包含了一种在正常情况下能阻断其表达的关键元素,利用ASO移除或调低该元件就会使得RBM3的产生得到持久性的提升。为了测试是否这种方法能保护大脑免于损伤,研究人员利用朊病毒感染的小鼠进行研究,其中一些小鼠在3周后被注射了单一剂量的ASO,而其它小鼠则接受了对照疗法进行治疗。在注射朊病毒12周后,接受对照疗法的小鼠患上了朊病毒病,且表现出了海马体中神经元的广泛缺失,海马体是大脑中负责记忆的关键区域。而接受ASO治疗的小鼠的情况则非常不同,当其它小鼠屈服于朊病毒病的同时,接受ASO治疗的小鼠机体中RBM3的水平是其它小鼠的两倍,8只接受ASO治疗的小鼠中有7只小鼠都表现为海马体中神经元的广泛保护。
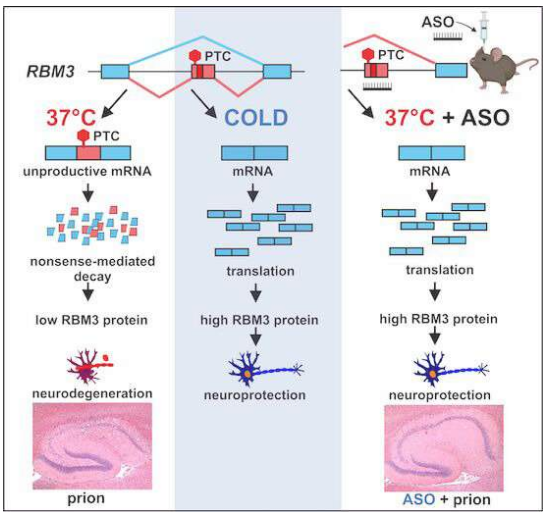
通过增强机体大脑中冷休克蛋白的水平或有望治疗一系列人类神经退行性疾病。
图片来源:EMBO Molecular Medicine (2023). DOI:10.15252/emmm.202217157
研究者Giovanna Mallucci教授说道,从本质上来讲,冷休克蛋白能促使大脑自我保护,在这种情况下就能抵御朊病毒病期间对大脑中神经细胞的损伤;而值得注意的是,本文研究结果表明,仅仅单一注射ASO或许就足以为这些小鼠提供长效的保护力,并预防不可避免的神经退行性疾病的发生和发展。这种方法或许能为保护机体抵御诸如阿尔兹海默病和帕金森疾病等神经退行性疾病提供新的希望,对于这些疾病而言,目前研究人员并没有可靠的预防性疗法。
由于本文研究是在小鼠机体中进行的,所以距离在人类机体中进行相关的试验还需要很长一段路要走,但如果研究人员能安全利用ASOs来增强人类机体中冷休克蛋白的产生,或许就有望帮助预防人类痴呆症的发生;如今研究人员也看到了ASOs的确能成功用于治疗脊髓性肌肉萎缩症(spinal muscular atrophy),而且其最近还被授权用于治疗人类的运动神经元疾病。如果这些研究发现能在人类机体中得到复制的话,这一方法或许对于治疗人类神经退行性疾病以外的其它疾病也具有重大意义,包括在心脏手术中通过保护大脑而引起的新生儿缺氧所致急性脑损伤、中风以及成年人的头部损伤,否则将会通过治疗性低温来对这些病症进行治疗。
综上,本文在小鼠研究中所得到的可喜成果或许支持了这样一种可能性,即RBM3所诱导的ASO或许可能在从急性脑损伤到阿尔兹海默病等一系列疾病患者机体中提供一定的神经保护作用。(生物谷Bioon.com)
原始出处:
Marco Preußner,Heather L Smith,Daniel Hughes, et al. ASO targeting RBM3 temperature‐controlled poison exon splicing prevents neurodegeneration in vivo, EMBO Molecular Medicine (2023). DOI: 10.15252/emmm.202217157
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


