《自然·代谢》:北大团队发现PD-1新功能!
来源:奇点糕 2022-08-25 17:51
这项研究发现,阻断PD-1信号通路会导致肠道淋巴组织诱导细胞(LTi)的代谢失调,进而影响LTi的功能,并最终导致肠道炎症的发生
作为一个著名的T细胞负调控因子,PD-1是癌症或慢性感染中T细胞功能障碍的标志。
如今,抗PD-1抗体已被用于恢复肿瘤浸润T细胞的功能,并成为最成功的癌症治疗方法之一。
尽管在临床上取得了一定的成功,但抗PD-1抗体的疗效在不同患者中仍有差异,并可能导致免疫相关不良事件(其中最常见的是结肠炎),但抗PD-1抗体导致不良反应的根本原因目前尚不完全清楚[1]。
最近的一些研究发现,除了T细胞,PD-1在其他的一些免疫细胞上也有着广泛表达,其中有一些细胞在维持肠道稳态中发挥了关键作用。那么,抗PD-1抗体是否可能会影响这些以前被忽视的免疫细胞,进而导致肠炎的发生呢?
前不久,北京大学钟超团队在《自然·代谢》期刊发表重要研究成果,这项研究发现,阻断PD-1信号通路会导致肠道淋巴组织诱导细胞(LTi)的代谢失调,进而影响LTi的功能,并最终导致肠道炎症的发生[2]。
这一发现进一步拓展了我们对PD-1功能的认知,并为抗PD-1抗体治疗所致结肠炎的防治提供了新的思路。

论文首页截图
天然淋巴细胞(ILCs)是近年来新发现的一群参与固有免疫的淋巴细胞,根据其功能可分为三个主要亚群。
1型ILC(ILC1和NK细胞)分泌IFN-γ,参与对细胞内病原体的保护;2型ILC(ILC2)通过分泌白细胞介素IL-5、IL-9、IL-13来保护宿主免受寄生虫感染。
相比之下,3型ILC(ILC3s)的分类较为复杂,它可以进一步分为表达趋化因子受体CCR6的LTi细胞亚群,表达天然细胞毒性受体(NCR)的亚群,以及既不表达CCR6也不表达NCR的双阴性亚群[3]。
在胚胎期,LTi细胞主要参与次级淋巴器官的形成。在小鼠成熟后,也有一群细胞在表型上与LTi细胞相似,但不能促进次级淋巴器官的形成,在有的文章中,会把这群LTi细胞称为LTi-like ILC3细胞,今天这篇文章关注的便是这群细胞[4]。
ILC3s是肠道中最丰富的ILCs,它们可以分泌细胞因子IL-22,IL-22可以介导抗菌反应和肠道屏障完整性的维持。因此,ILC3s在维持肠道稳态中有着重要作用[5]。
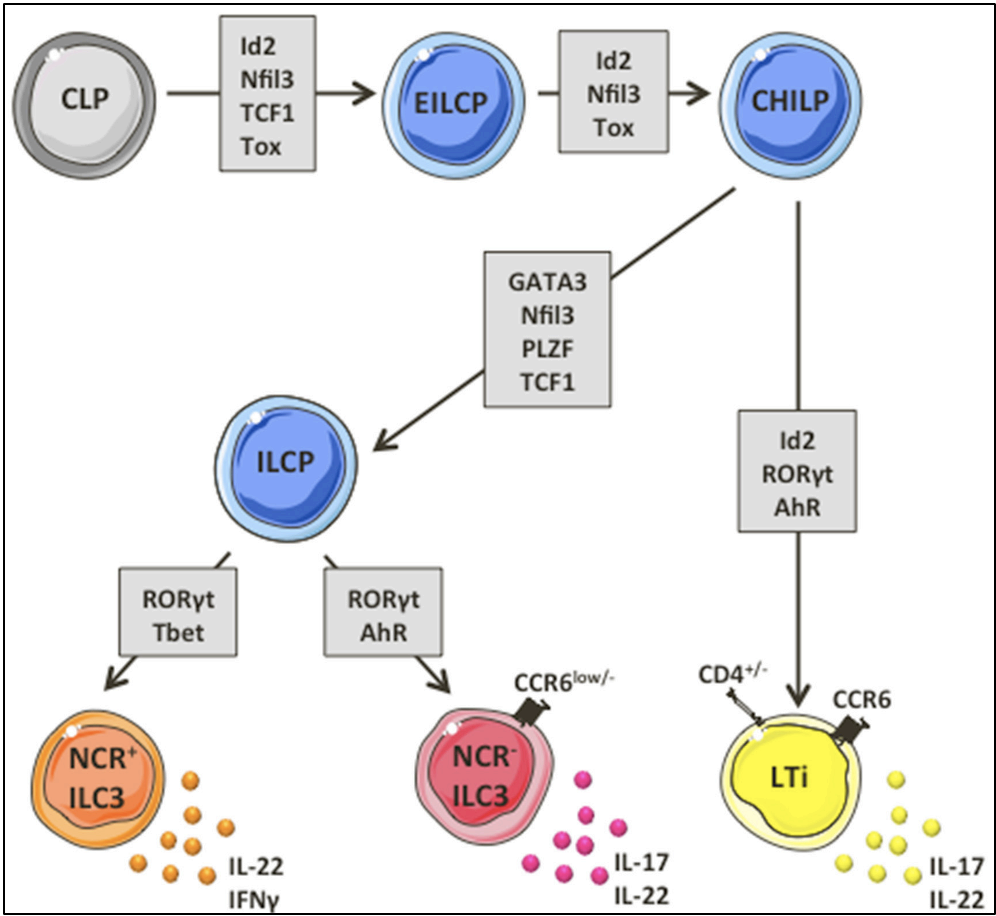
3型天然淋巴细胞发育过程[5]
之前已有研究发现,PD-1表达于ILC前体细胞,并不同程度地表达于成熟的ILC2s(20-40%)、ILC3s(20-30%)和LTi细胞(高达76%),而传统的NK细胞或ILC1s需要活化才能表达[6]。
还有研究表明,阻断PD-1信号通路可增强NK细胞和ILC2s的功能[7-9]。然而,PD-1是如何调节ILCs细胞功能的,尤其在癌症治疗的背景下,目前还不是很清楚。
考虑到结肠炎是抗PD-1抗体治疗中常见的不良反应,钟超团队的研究人员首先分析了结肠炎背景下PD-1的作用。
他们发现,PD-1敲除小鼠(Pdcd1-/-)对葡聚糖硫酸钠(DSS)诱导的肠炎的易感性增加,肠道稳态受损更为严重。此外,在缺乏适应性免疫细胞的小鼠中敲除PD-1(Pdcd1-/-Rag2-/-)也能加重肠炎的发生,这说明PD-1可能在天然免疫反应的调节中发挥关键作用。
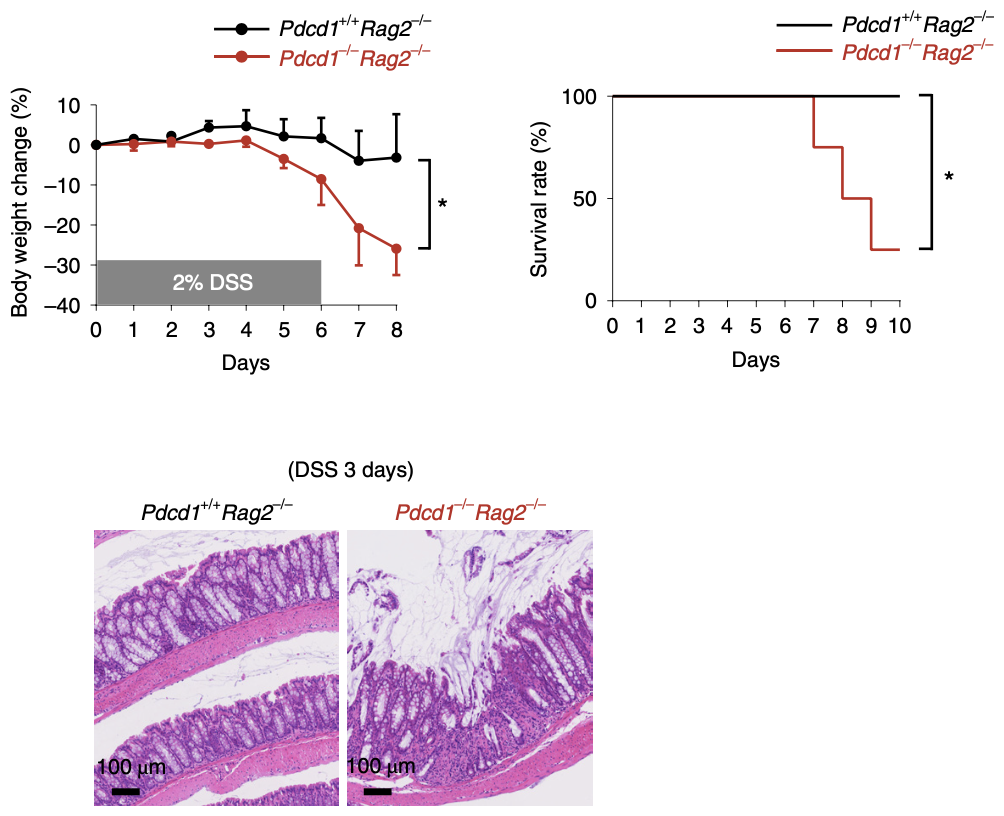
在缺乏适应性免疫细胞的小鼠中敲除PD-1也能加重DSS诱导的肠炎的发生
因此,研究人员对结肠中的天然免疫细胞进行了分析,结果发现LTi细胞和ILC2s显著表达PD-1。之前的研究已经知道,LTi细胞是结肠中IL-22的主要来源,IL-22在限制肠道炎症和维持肠道中发挥关键作用[10],并在DSS诱导的结肠炎中发挥保护作用[11]。
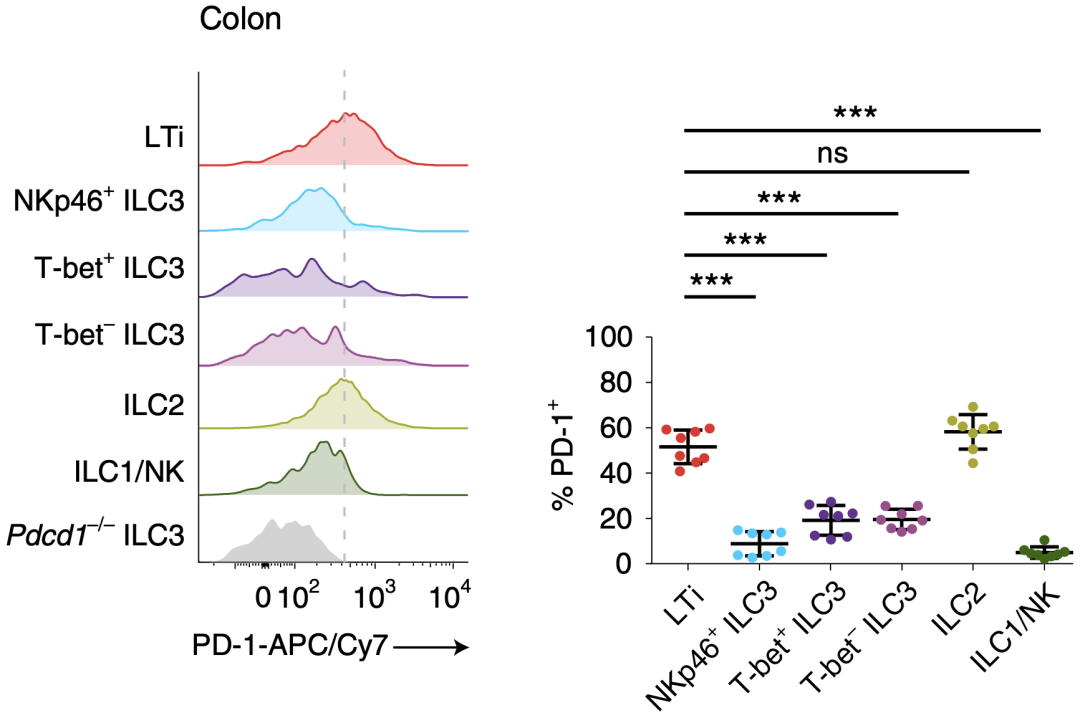
结肠中的LTi和ILC2s细胞高表达PD-1
钟超团队进一步的分析发现,与从小肠分离的LTi细胞相比,结肠和盲肠LTi细胞上PD-1高表达,这可能与该区域的高细菌负荷相关。
为了证明这一相关性,研究人员使用抗生素甲硝唑处理小鼠,结果发现LTi细胞上PD-1表达显著下调,这表明肠道菌群对诱导LTi细胞上PD-1的表达有着重要作用。
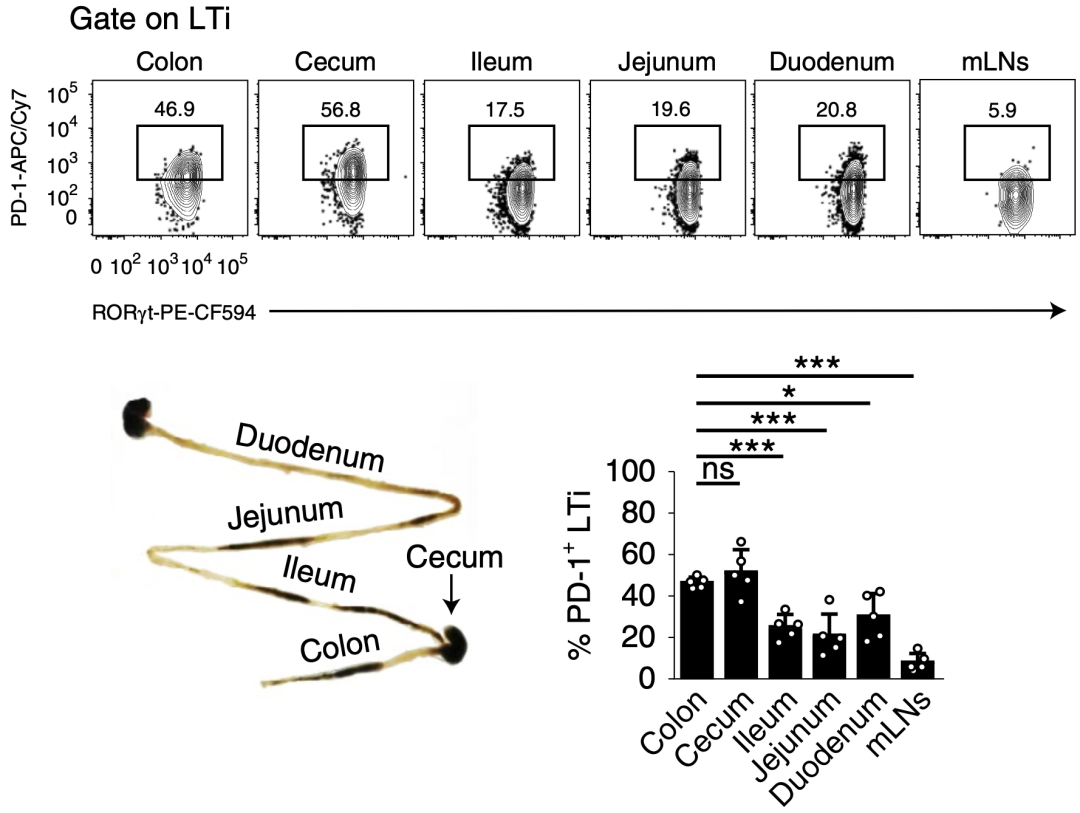
与从小肠分离的LTi细胞相比,结肠和盲肠的LTi细胞上PD-1的表达更高
那么,LTi细胞上的PD-1发挥了怎样的功能呢?
研究人员发现,在敲除PD-1后,LTi细胞的IL-22产生明显受损,这表明PD-1的表达对维持LTi细胞的效应功能有着重要作用。
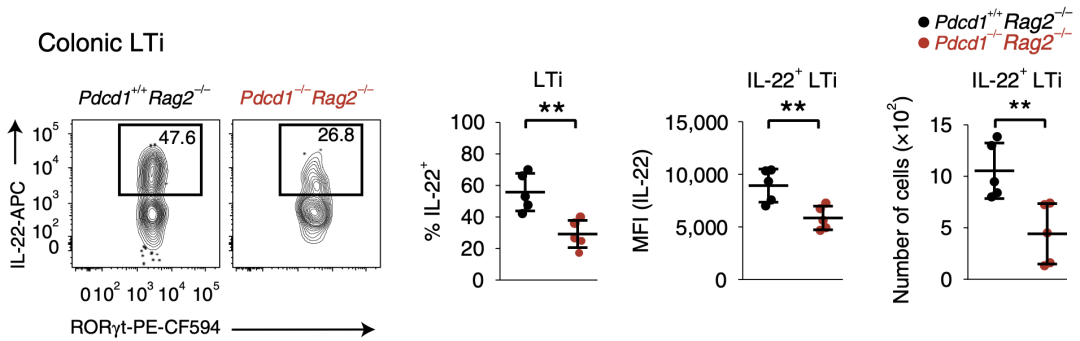
敲除PD-1可导致LTi细胞的IL-22表达量降低
为了进一步研究PD-1信号对LTi细胞的影响,研究人员用人Pdcd1的细胞外和跨膜区基因序列取代鼠的同源序列,构建PD-1人源化的小鼠(Pdcd1h/h),人源化的PD-1不能与鼠PD-L1结合,因此不能介导PD-1下游信号的产生。他们发现,PD-1人源化小鼠LTi细胞的IL-22表达量降低,这说明PD-1信号通路影响了IL-22的产生。
接着,研究人员通过RNA测序(RNA-seq)分析来进一步揭示PD-1调控LTi细胞活化的机制。他们发现,只有PD-1信号通路完整的LTi细胞,才会上调参与LTi细胞活化的相关基因。
此外,研究人员还注意到PD-1的缺失导致了LTi细胞的代谢重编程,主要表现为糖酵解减少和脂肪酸氧化(FAO)的增多。
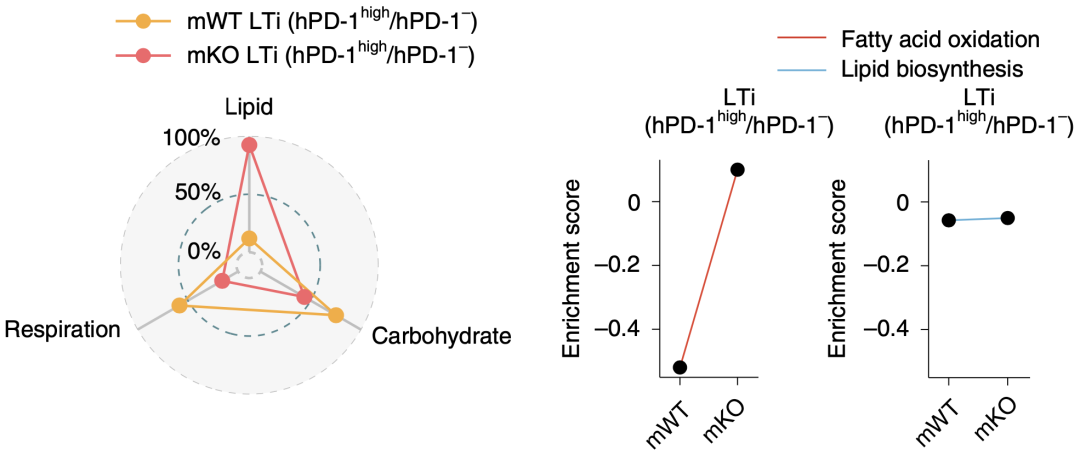
PD-1信号的缺失导致了LTi细胞的代谢重编程
为了证明脂肪酸氧化对LTi细胞功能的影响,研究人员通过在LTi细胞中添加棕榈酸,或用高脂饲料喂养小鼠,来增强脂肪酸氧化,结果发现这些均可导致LTi细胞的IL-22表达显著降低。此外,抑制脂肪酸氧化则可恢复PD-1敲除的LTi细胞生成IL-22的能力。
总的来说,这些结果揭示了PD-1作为天然淋巴细胞的代谢检查点的关键作用,LTi细胞中PD-1的缺失会导致细胞脂肪酸氧化增强,并导致其功能受损,而抑制脂肪酸氧化可以促进LTi细胞的活化和功能。
这一发现提示PD-1在LTi细胞中的功能似乎与其他免疫细胞中的功能不同。T细胞和ILC2中的PD-1缺失可以增强了它们的效应功能,但LTi细胞中PD-1的缺失会导致其功能受损。
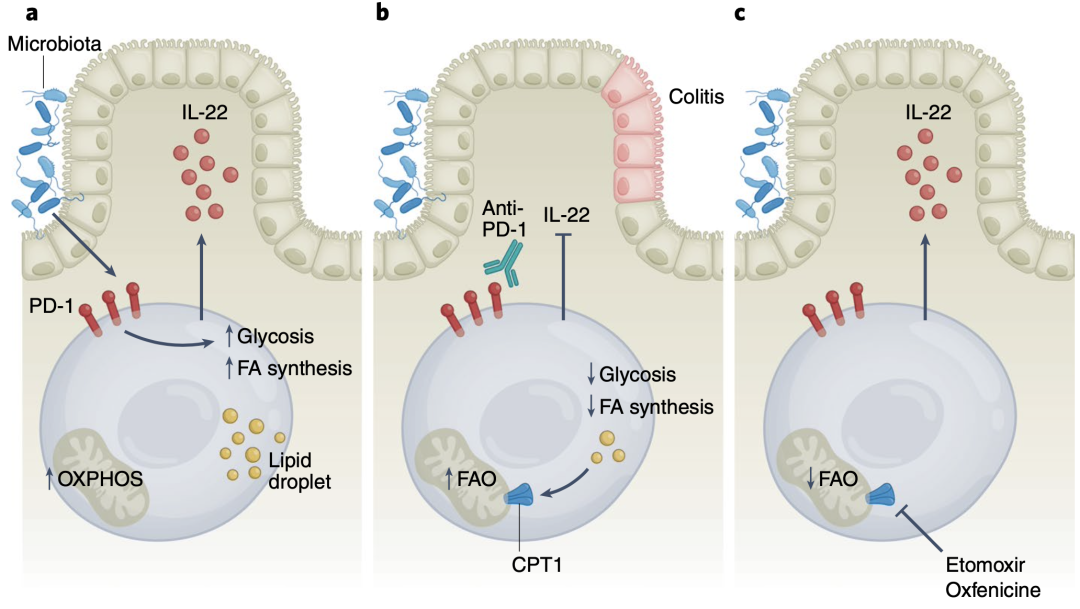
PD-1调节LTi细胞的代谢和功能
当然,这项研究还有一些问题值得进一步探究。例如,文章发现脂质代谢异常是导致LTi细胞功能障碍的重要因素,但脂肪酸氧化具体是如何损害IL-22产生的,还需要进一步的研究来阐释。
值得一提的是,过量的脂肪酸会促进LTi细胞中的脂肪酸氧化,并减少IL-22的产生,这在肥胖的背景下也可能是一个特别严重的问题,肥胖患者也更容易发生抗PD-1抗体引起的肠道并发症。因此,抑制脂肪酸氧化对于干预肠道炎症可能有着重要意义。
参考文献
1.Patsoukis N, Wang Q, Strauss L, Boussiotis VA: Revisiting the PD-1 pathway. Sci Adv 2020, 6(38).
2.Wu D, Hu L, Han M, Deng Y, Zhang Y, Ren G, Zhao X, Li Z, Li P, Zhang Y et al: PD-1 signaling facilitates activation of lymphoid tissue inducer cells by restraining fatty acid oxidation. Nature Metabolism 2022.
3.Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie ANJ, Mebius RE et al: Innate Lymphoid Cells: 10 Years On. Cell 2018, 174(5):1054-1066.
4.Zhong C, Zheng M, Zhu J: Lymphoid tissue inducer-A divergent member of the ILC family. Cytokine Growth Factor Rev 2018, 42:5-12.
5.Pantazi E, Powell N: Group 3 ILCs: Peacekeepers or Troublemakers? What's Your Gut Telling You?! Front Immunol 2019, 10:676.
6.Yu Y, Tsang JC, Wang C, Clare S, Wang J, Chen X, Brandt C, Kane L, Campos LS, Lu L et al: Single-cell RNA-seq identifies a PD-1(hi) ILC progenitor and defines its development pathway. Nature 2016, 539(7627):102-106.
7.Helou DG, Shafiei-Jahani P, Lo R, Howard E, Hurrell BP, Galle-Treger L, Painter JD, Lewis G, Soroosh P, Sharpe AH et al: PD-1 pathway regulates ILC2 metabolism and PD-1 agonist treatment ameliorates airway hyperreactivity. Nat Commun 2020, 11(1):3998.
8.Taylor S, Huang Y, Mallett G, Stathopoulou C, Felizardo TC, Sun MA, Martin EL, Zhu N, Woodward EL, Elias MS et al: PD-1 regulates KLRG1(+) group 2 innate lymphoid cells. J Exp Med 2017, 214(6):1663-1678.
9.Hsu J, Hodgins JJ, Marathe M, Nicolai CJ, Bourgeois-Daigneault MC, Trevino TN, Azimi CS, Scheer AK, Randolph HE, Thompson TW et al: Contribution of NK cells to immunotherapy mediated by PD-1/PD-L1 blockade. J Clin Invest 2018, 128(10):4654-4668.
10.Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, Blumberg RS, Xavier RJ, Mizoguchi A: IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest 2008, 118(2):534-544.
11.Sawa S, Lochner M, Satoh-Takayama N, Dulauroy S, Berard M, Kleinschek M, Cua D, Di Santo JP, Eberl G: RORgammat+ innate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota. Nat Immunol 2011, 12(4):320-326.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


