Nature Methods : 如何利用单细胞RNA测序解读人类胚胎发育的每一步?
来源:生物探索 2024-12-09 10:28
研究人员借助干细胞技术构建了胚胎模型(stem cell-based embryo models),用于模拟人类胚胎的发育。
Nature Methods “A comprehensive human embryo reference tool using single-cell RNA-sequencing data”,研究人员采用scRNA-seq,对人类胚胎在不同发育阶段的细胞进行全面分析,最终构建了一份从受精卵到原肠胚的基因表达参考图谱。

人类胚胎的早期发育过程是解开生命起源的关键环节。这个过程不仅能帮助研究人员回答“我们从哪里来”这一古老的命题,还为解决不孕不育、早期流产以及先天性疾病提供了宝贵的线索。然而,由于伦理和法律的限制,直接研究人类胚胎存在诸多挑战。比如,“14天规则”限制了对胚胎研究的时间窗口,只允许在胚胎发育的前14天内进行研究,这使得研究人员难以深入探索原肠胚阶段及其后的发育过程。
为了应对这些挑战,研究人员借助干细胞技术构建了胚胎模型(stem cell-based embryo models),用于模拟人类胚胎的发育。这些模型的可靠性需要通过对比真实胚胎的数据来加以验证。研究人员利用单细胞RNA测序技术,对这些模型与真实胚胎的基因表达谱进行比较,以确保它们在分子水平上能够忠实再现人类胚胎的发育过程。这种比较不仅帮助优化胚胎模型的构建,还为理解胚胎发育中的分子机制提供了更深刻的见解。
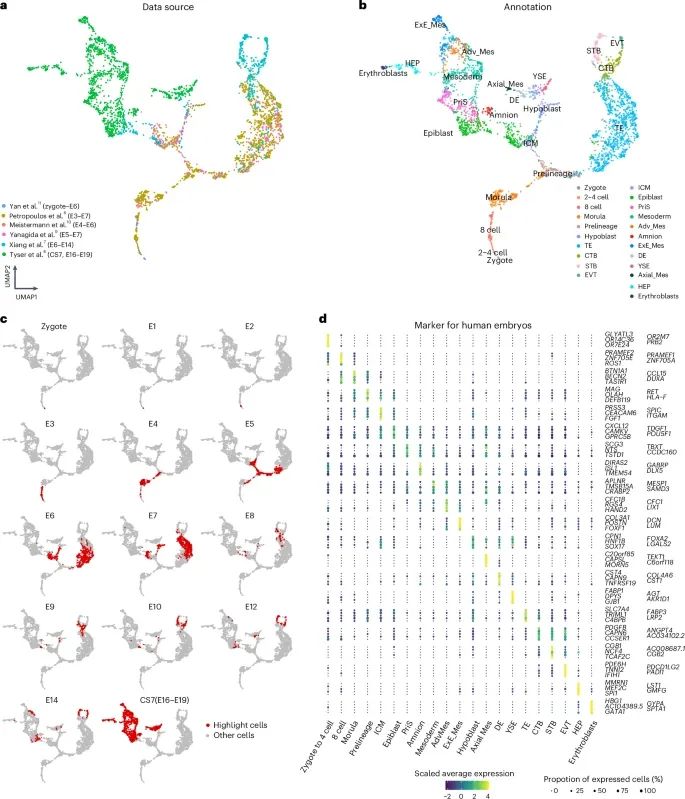
从受精卵到原肠胚的人类胚胎参考图谱构建(Credit: Nature Methods)
利用单细胞RNA测序技术整合六个公开数据集,构建从受精卵到原肠胚阶段的人类胚胎参考图谱的过程。包括:通过UMAP(统一流形近似与投影)技术,将来自不同数据集的3,304个早期人类胚胎细胞嵌入到同一个二维空间中,形成连续的发育轨迹。这些数据集包含了培养的植入前人类胚胎、三维培养的植入后胚泡及CS7的原肠胚细胞。
UMAP图显示了不同时间点的细胞分布和发育进程,展示了从内细胞团(ICM)和滋养层(TE)的分化,到胚胎外胚层(Epiblast)、下胚层(Hypoblast)、羊膜(Amnion)、原条(Primitive Streak, PriS)、中胚层(Mesoderm)及最终内胚层(Definitive Endoderm, DE)的形成。图中的UMAP还揭示了滋养层细胞的进一步分化,如细胞滋养层(CTB)、合胞滋养层(STB)和外绒毛滋养层(EVT),以及胚胎外谱系如卵黄囊内胚层(YSE)、胚外中胚层(ExE_Mes)等。图中还包括一个点图,用于说明用于胚胎参考图谱的五个谱系特异性基因的表达情况,展示了这些基因在不同细胞类型中的表达比例和表达值。
构建人类胚胎参考图谱:绘制生命的路线图
为了构建一个全面而系统的人类胚胎基因表达参考图谱,研究人员整合了六个公开的胚胎单细胞RNA测序数据集,涵盖了从受精卵到原肠胚的多个关键发育时间点。通过“统一流形近似与投影”(Uniform Manifold Approximation and Projection, UMAP)技术,研究团队将这些胚胎细胞嵌入到一个二维空间中,生成了一张高分辨率的发育“路线图”。
这些数据集包含了从受精卵到胚胎发育第19天(E19)各阶段的细胞信息。例如,Yan等人的数据集涵盖了从受精卵到第6天(E6)的早期发育阶段,而Xiang等人的数据则涵盖了第6天到第14天(E14)的阶段。通过整合这些数据,研究人员共分析了3304个胚胎细胞,详细描绘了不同发育阶段中的基因表达变化和细胞分化过程。
在参考图谱中,研究人员能够清晰地看到细胞类型逐步分化的轨迹。例如,在胚胎发育的第5天(E5),内细胞团(Inner Cell Mass, ICM)和滋养层(Trophectoderm, TE)首次分化,随后内细胞团进一步分化为胚胎外胚层(Epiblast)和下胚层(Hypoblast)。通过UMAP图谱,研究人员能够观察到胚胎外胚层细胞如何分化为晚期的胚胎外胚层、羊膜(Amnion)、原条(Primitive Streak, PriS)、中胚层(Mesoderm)和最终的内胚层(Definitive Endoderm, DE)。
这些数据不仅展示了不同发育阶段细胞类型的变化,还揭示了细胞之间的相互关系和信号通路的动态变化。例如,研究发现滋养层细胞的分化过程中,Wnt和BMP信号通路的活性显著变化,这表明它们在胚胎发育中扮演着重要的调控角色。通过这些研究,研究人员得以追踪细胞类型从未分化状态到功能化的整个动态过程。
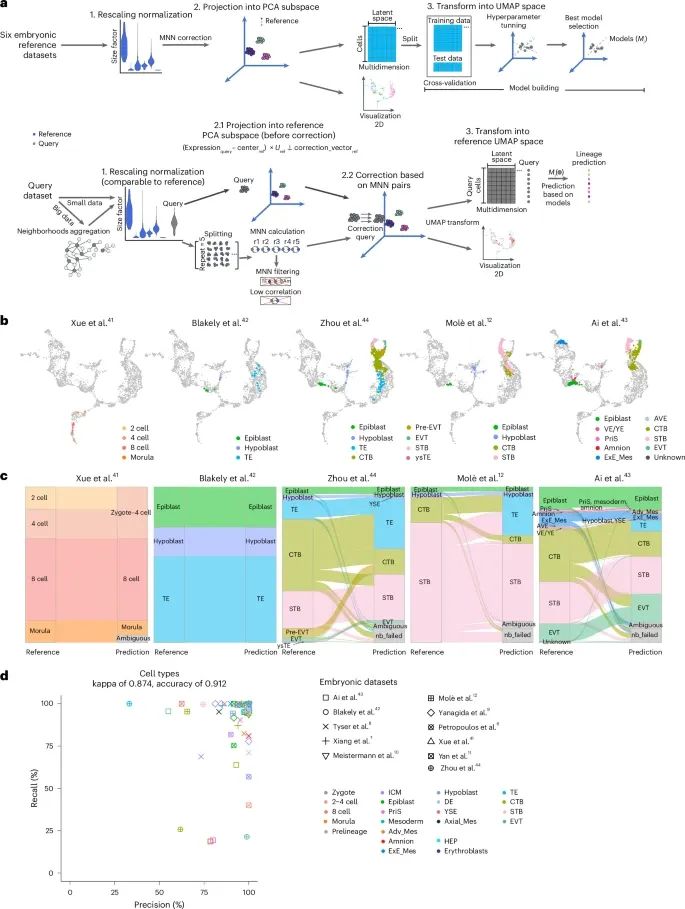
验证早期胚胎发生预测工具(Credit: Nature Methods)
预测工具的工作流程:包括数据处理和预测的各个步骤。首先,查询数据进行了归一化处理,以确保其表达值与参考数据集具有可比性。然后,数据被投影到主成分分析(PCA)子空间,并通过匹配最近邻对(MNN)进行批次校正,最终使用UMAP模型进行可视化。预测工具利用支持向量机(SVM)模型在相同的潜在空间中预测细胞身份。
不同胚胎数据集的投影:图中展示了将五个不同的胚胎数据集投影到构建的人类胚胎参考图谱上。图中不同颜色代表了来自各个研究的细胞注释,而参考图谱中的细胞以浅灰色标记。
细胞类型预测的验证:通过弦流图比较了原始细胞类型与预测工具的预测结果。图中标注了“ambiguous”(模糊)和“nb_failed”(邻域形成失败)等类别,用于表示预测不确定的细胞或未能形成邻域的细胞。
预测工具的精度与召回率:展示了在每个胚胎数据集中的不同细胞类型的预测精度和召回率。不同形状和颜色代表了查询的细胞类型和数据来源。结果显示该工具对所有胚胎数据集中的各条谱系表现出较高的预测精度和召回率。
干细胞模型的验证与挑战
构建人类胚胎参考图谱的一个核心目标是验证基于干细胞的胚胎模型的准确性。研究人员将不同来源的干细胞(例如,原始干细胞(Primed human pluripotent stem cells, hPS))映射到参考图谱中,以评估这些细胞与真实胚胎细胞的相似程度。研究结果表明,原始干细胞通常与晚期胚胎外胚层细胞的基因表达相似,而“天真型”的hPS细胞(naive hPS cells)则更接近于早期胚胎外胚层细胞。
这种对比对于检测模型中的潜在误注释至关重要。如果没有参考图谱,干细胞模型可能存在错误注释的风险。例如,一些由天真和原始干细胞分化的细胞可能显示出羊膜或胚外中胚层(Extraembryonic Mesoderm, ExE_Mes)细胞的特征,而不是预期的滋养层细胞。这强调了使用准确参考数据来验证干细胞模型的必要性。
在验证过程中,研究人员还使用了单细胞调控网络推断与聚类分析(SCENIC)工具,来探究各发育阶段中转录因子的活性。例如,DUXA在8细胞期的高表达、VENTX在胚胎外胚层中的富集,以及TEAD3在滋养层中的表达,这些结果进一步确认了不同细胞系的特性及其在发育中的关键作用。
跨物种比较与进化启示
为了更好地理解人类胚胎发育的独特性,研究人员还将这些人类胚胎数据与非人灵长类(如猕猴和绒猴)的胚胎数据进行了比较。通过这种跨物种的数据整合,研究人员发现,从受精卵到内细胞团、滋养层、胚胎外胚层等各个阶段的发育路径在人类和其他灵长类之间具有高度保守性。这种保守性为理解灵长类胚胎发育的共同机制提供了有力支持,同时也帮助揭示了人类特有的基因表达模式。
通过这种跨物种对比,研究人员还识别出一些在人类胚胎中特有的基因表达特征,例如FAM124A和MUSTN1。这些基因在其他灵长类中并没有类似的表达特征,提示它们在人类发育过程中可能具有独特功能。此外,研究还揭示了不同物种在胚胎发育中的调控差异,这些差异可能解释了物种之间在胚胎形态和发育速度上的不同。
研究进一步揭示了某些基因在灵长类胚胎中的保守功能。例如,FOXA2在人类、猕猴和绒猴的胚胎发育中均有类似的表达模式,表明其在早期发育中的重要性。同时,一些基因表达的差异性则反映了物种特有的调控机制,这为进一步理解人类胚胎发育的独特性提供了新见解。
从受精卵到细胞系:重建发育轨迹
为了深入了解细胞分化的动态过程,研究人员使用了“Slingshot”轨迹推断算法,对胚胎外胚层、下胚层和滋养层细胞的发育轨迹进行了重建。结果表明,有数百个转录因子在这些发育轨迹中表现出显著的调控作用。例如,DUXA和FOXR1在桑椹胚阶段的高表达,随着细胞进一步分化而逐渐减少。而多能性标志基因NANOG和POU5F1在胚胎外胚层的发育轨迹中,从胚胎着床前的高表达到着床后的逐步下降,反映出它们在胚胎发育中的阶段性角色。
这种发育轨迹的分析揭示了细胞类型在不同发育阶段中的动态变化,以及它们在整体胚胎发育中的相互依赖性。研究发现,胚胎外胚层的分化与羊膜的形成密切相关,而中胚层的分化则依赖于原条的形成。这些发现为理解胚胎发育过程中不同组织之间的协同作用提供了宝贵的信息。此外,研究还发现了一些非编码RNA在发育轨迹中的动态变化,暗示它们可能在胚胎发育的调控中发挥关键作用。
从基础研究到临床应用
人类胚胎单细胞RNA参考图谱的构建,不仅为基础科学研究提供了一个重要工具,还在临床医学领域展现出广阔的应用前景。借助这一图谱,研究人员能够更精确地评估用于辅助生殖技术的胚胎质量,识别早期胚胎中的发育异常,提高体外受精(IVF)的成功率。此外,这一参考图谱也可以用于优化干细胞培养条件,推动再生医学和个性化治疗的发展。
在生殖与发育生物学研究中,干细胞胚胎模型是一种不可替代的工具。然而,只有通过与真实人类胚胎的详细对比,才能确保这些模型在细胞和基因水平上的准确性和可靠性。该研究描述的人类胚胎参考图谱,为这一验证过程提供了标准化的平台。这张图谱不仅展示了从受精卵到原肠胚的连续发育过程,还揭示了细胞分化和基因表达的复杂性与动态性。
未来,随着更多高质量单细胞数据的积累,我们有望构建更为详尽的参考图谱,涵盖从早期胚胎到器官发育的全过程。这将为再生医学、干细胞研究及发育障碍的诊断与治疗提供更加坚实的科学基础。此外,结合基因编辑技术和单细胞分析工具,未来的研究可能揭示人类胚胎发育中的关键基因网络及其调控机制,从而加速再生疗法的临床应用。
未来的胚胎研究可能还会结合蛋白质组学和表观遗传学等多层次数据,以更全面地揭示细胞命运决定和组织分化的调控机制。这些进展将有助于提高我们对发育生物学的系统性理解,并为个性化医学提供新的解决方案。最终,这些研究成果将为解决生殖健康问题、提高辅助生殖技术的成功率,并推动再生医学的突破性发展做出重要贡献。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


