J Immunother Cancer:嵌合非抗原受体在基于T细胞癌症治疗中的应用
来源:生物谷 2021-08-27 17:12
过继转移的基于T细胞的癌症疗法在治疗各种癌症方面显示出令人难以置信的前景,到目前为止,使用T细胞的治疗策略主要集中在操纵抗原识别机制本身,例如通过选择性表达肿瘤抗原特异性T细胞受体或工程抗原识别嵌合抗原受体(CAR)。
过继转移的基于T细胞的癌症疗法在治疗各种癌症方面显示出令人难以置信的前景,到目前为止,使用T细胞的治疗策略主要集中在操纵抗原识别机制本身,例如通过选择性表达肿瘤抗原特异性T细胞受体或工程抗原识别嵌合抗原受体(CAR)。虽然几种CAR已被批准用于治疗造血系统恶性肿瘤,但这种疗法在治疗实体瘤方面不太成功,部分原因是缺乏合适的肿瘤特异性靶点、免疫抑制性肿瘤微环境以及无法过继转移细胞以保持其治疗潜力。
图片来源:http://dx.doi.org/10.1136/jitc-2021-002628
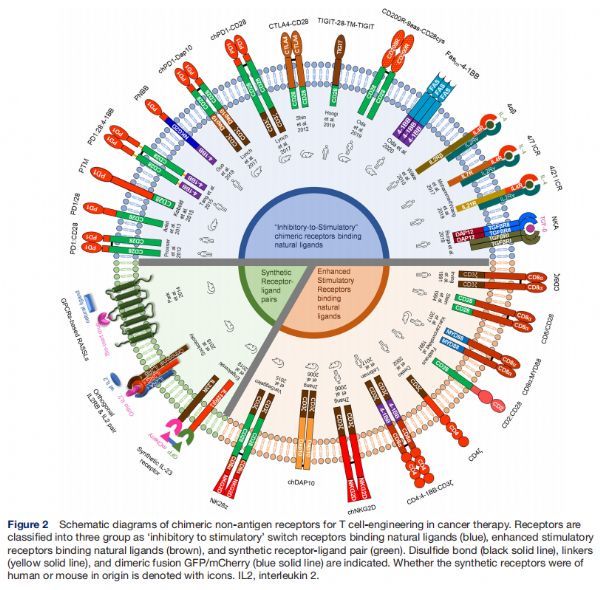
T细胞生物工程在癌症免疫治疗中的首要目标是将所需的T细胞促炎和细胞毒性作用导向肿瘤细胞,同时防止不必要的脱靶效应或误导性炎症,基于这些目标,嵌合非抗原受体被设计成为CAR或T细胞受体(TCR)抗肿瘤T细胞反应提供支持性共信号传递。天然免疫受体的结构域、较小的基序甚至关键残基是每个受体的基本功能亚基,只要保持其结构背景,许多域和基序就表现出高功能保真度,使它们可以作为功能模块移植到嵌合蛋白中。本文介绍了与调节T细胞抗肿瘤反应相关的天然免疫受体的各种亚基的功能,以及根据功能和配体类型,将这些受体分为三类:结合天然配体的“抑制到刺激”转换受体、与生物配体相互作用的增强刺激受体和合成受体-配体对。
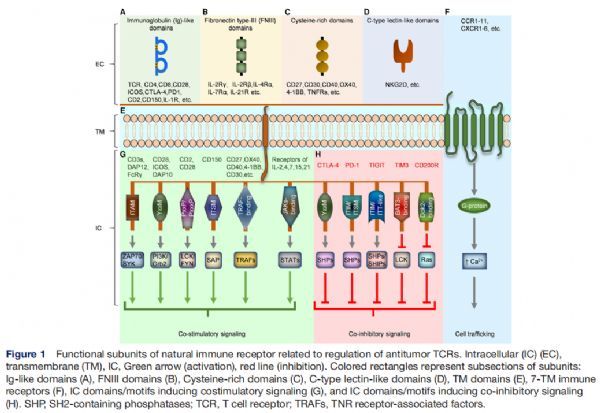
与调节抗肿瘤TCR相关的天然免疫受体功能亚基 图片来源:http://dx.doi.org/10.1136/jitc-2021-002628
四种主要的细胞外结构域原型通常被整合到T细胞上的天然受体中。首先,免疫球蛋白(Ig)样结构域在配体识别的免疫受体之间广泛共享,包括TCR亚基、共受体(如CD4和CD8)、CD28受体家族(如CD28、ICOS、CTLA-4和PD1)、CD2受体家族(如CD2和CD150)和白细胞介素1 (IL-1) 细胞因子受体。其次,纤连蛋白III型(FNIII)域在拓扑上类似于Ig样域,FNIII结构域存在于常见γ链受体家族(如IL-2、IL-7、IL-15和IL-21)的细胞外部分。第三种高度共享的胞外域是肿瘤坏死因子受体(TNFR)超家族的富含半胱氨酸的域,其中包括CD27、CD30、CD40、OX40和4-1BB等共刺激受体以及肿瘤坏死因子(TNF)细胞因子受体。TNFR胞外域可与胞内TNF受体相关因子(TRAF)偶联以介导各种促炎或增殖信号(如CD40和TNFR2)、死亡域(DD)以介导细胞死亡(如Fas或TNFR1),或可以是非膜结合的和独立地作为可溶性或诱饵受体发挥作用。最后,在适应性免疫细胞中,C型凝集素受体(CLR)结构域不如前三种细胞外结构域类型常见,但被认为可能是嵌合受体的重要组成部分。一种CLR家族NKG2在自然杀伤(NK)和T细胞上表达,并调节促炎和抗炎作用以响应自身细胞(包括癌细胞)上的应激诱导分子。在T细胞上自然表达的受体中存在两大跨膜类别:单通道(双位)或多通道(多位)。双位跨膜结构域非常常见,包含不同数量的疏水残基,允许插入疏水脂质膜;然而选择的亲水或带电残基与膜近端二硫键和细胞外结构域相互作用共同促进聚合,如TCR复合物本身与六个单独的CD3分子、两个TCR分子和CD4或CD8,所有这些都具有单独的单程跨膜结构域。多位受体,如突出的G蛋白偶联受体 (GPCR) 家族在免疫细胞中也很常见,包括CXCR1-6 和CCR1-11在内的GPCR趋化因子受体家族,定义为由七个α螺旋穿过膜形成桶状。
用于癌症治疗中T细胞工程的嵌合非抗原受体示意图 图片来源:http://dx.doi.org/10.1136/jitc-2021-002628
免疫受体中使用了多种细胞内结构域来介导多种激活和抑制功能,在某些情况下,整个域被认为是激活或抑制的,如在TNFR家族成员使用的TRAF和DD中,并且特定的氨基酸序列或基序能够执行特定的功能。两种常见的对立基序是基于免疫受体酪氨酸的激活和抑制基序(分别为ITAM和ITIM)。一些细胞内结构域的更多特征具有明确定义的作用,如,TIM-3没有已知的抑制基序,它在T细胞调节中的作用取决于关键酪氨酸残基265和272位的磷酸化,以及随后与人白细胞抗原(HLA-B)相关转录因子3的相互作用。而一些分子使用基序组合来微调激活和抑制之间的平衡,CD150有两个基于免疫受体酪氨酸的开关基序 (ITSM),它们通过SLAM相关蛋白发挥作用,为T细胞增殖和干扰素-γ产生提供激活信号。该研究根据功能和配体类型,将这些受体分为三类:(1)结合天然配体的“抑制到刺激”转换受体,(2)与生物配体相互作用的增强刺激受体,(3)合成受体-配体对。
由于T细胞生物学、生物工程和生物技术的发展,用于癌症治疗的T细胞工程正在迅速发展。天然免疫受体及其信号域的模块化设计允许它们被分离并移植到具有特定功能的合成分子中,嵌合非抗原受体已与肿瘤抗原受体CAR和TCR一起开发,在提高基于T细胞的癌症治疗的疗效方面具有巨大潜力。此外,当不同的结构域任意融合在一起作为嵌合蛋白时,可能会发生意想不到的调节,在人类应用之前,应仔细评估此类非天然生物元件的所有特性包括功能、调节和免疫原性。(生物谷 bioon)
参考文献
Jitao Guo et al. Chimeric non-antigen receptors in T cell-based cancer therapy. Journal for ImmunoTherapy of Cancer (2021 Aug 03) doi:http://dx.doi.org/10.1136/jitc-2021-002628
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。