Nature子刊: 乳腺癌ERα+表型需要压缩应力介导的p38激活
来源:本站原创 2021-12-14 13:36
乳腺癌现在是全球最常见的癌症,也是女性死亡的主要原因。三分之二的乳腺癌表达管腔雌激素受体阳性(ERα+)表型,这种表型最初对抗激素治疗有反应,但出现了耐药性。
乳腺癌现在是全球最常见的癌症,也是女性死亡的主要原因。三分之二的乳腺癌表达管腔雌激素受体阳性(ERα+)表型,这种表型最初对抗激素治疗有反应,但出现了耐药性。理解ERα途径生物学和治疗发现的一个主要障碍是管腔ERα+乳腺癌模型的限制指标。ERα+表型在培养细胞中不稳定,原因尚不完全清楚。
图片来源: https://doi.org/10.1038/s41467-021-27220-9
根据特定的治疗上可操作的生物标记物和基因表达谱,乳腺癌通常被分为四种分子亚型。在所有新诊断的乳腺癌中,约80%具有腔细胞表型,并且表达雌激素受体(ER-α)。这些乳腺癌被称为腔型A或B亚型,与更具侵袭性的ERα阴性亚型、富含HER2的(HER2+,E Rα-)和三阴性/基底细胞样型(TNBC)相比,它们的预后相对较好。虽然局限性早期乳腺癌的总体预后通常很好,但明显转移的疾病仍被认为是无法治愈的。
晚期ERα+(her2-)乳腺癌的治疗选择通常包括内分泌治疗,如芳香化酶抑制剂或选择性雌激素受体降解剂/调节剂(serd和serm),单独使用或联合靶向治疗,如细胞周期蛋白依赖性激酶抑制剂或mTOR抑制剂。ER-α阳性的腔型乳腺癌的共性,以及ER-α通路抑制剂在治疗中的有效性和广泛应用,预示着这一生物学仍将是研究和药物开发的主要焦点。
尽管需要新的ERα通路靶向药物,但目前仅有少数ERα+临床前模型可用于药物的发现、开发和测试。建立ERα+腔内乳腺癌细胞系是一项具有挑战性的任务,其原因尚不完全清楚。在细胞培养系统中,腔内ERα+肿瘤细胞要么被其他类型的细胞竞争,要么迅速下调ERα的表达。事实上,大约三分之二基于细胞系的ERα+乳腺癌研究结果来自于一小部分细胞系的结果,如MCF7、T47D和CAMA1。
短期患者来源的肿瘤外植体培养(PDEC)系统提供了比还原性细胞培养更多的潜在好处,包括肿瘤特异性遗传和表型的异质性,以及在真实的肿瘤微环境成分的背景下探索肿瘤细胞行为的机会。患者衍生的体外肿瘤外植体同时提供患者特定的临床和分子信息源和活体肿瘤样本,用于根据所获得的分子信息测试治疗方案。因此,PDECs作为下一代个性化医疗工具前景看好。不幸的是,体外肿瘤组织模型通常也显示在已报道的培养条件下ERα的表达迅速丧失。
总结主要调查结果的模型图
图片来源: https://doi.org/10.1038/s41467-021-27220-9
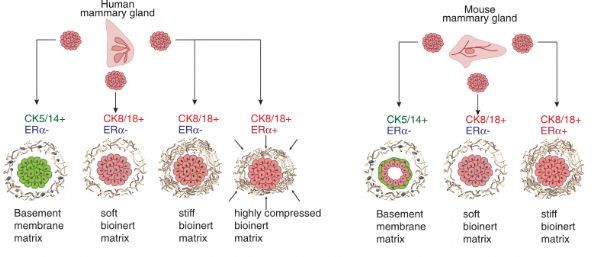
在这里,作者报告了如何设计和构建细胞外基质支架,以保存患者来源的人乳腺组织(PDEC-N)和乳腺癌(PDEC-BC)外植体培养中的管腔ERα+表型。作者发现,培养基质的生理硬度和乳腺组织微环境通过p38/应激激活蛋白激酶介导的应激通路和依赖于H3K27me3的表观遗传染色质重塑与腔上皮细胞和癌细胞中ERα的表达相耦合。
虽然这项研究中使用的最硬的水凝胶足以维持小鼠来源的外植体中ERα的表达,但在人类外植体中诱导应激和激素途径需要大约20倍的有效硬度。作者发现ERα在乳腺癌中的表达与腔细胞特性无关,而是一条独立的细胞外基质刚性调节的细胞通路。(生物谷 Bioon.com)
参考文献
Pauliina M Munne et al. Compressive
stress-mediated p38 activation required for ERα+phenotype in breast cancer. Nat
Commun. 2021 Nov 29;12(1):6967. doi: 10.1038/s41467-021-27220-9.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。