“氟”星高照!首个我国自主知识产权的PARP抑制剂获批晚期卵巢癌一线维持治疗
来源:奇点糕 2024-05-26 10:41
希望氟唑帕利这个由我国自主研发的“福星”,能照耀更多我国晚期卵巢癌患者,并给她们带来更好的生存获益。
在2022年,全球有超过20万女性死于卵巢癌[1],中国占到其中近六分之一[2]。
卵巢癌之恶,体现在三个70%。具体来说,70%卵巢癌发现即晚期、70%患者会在2年内复发、70%的卵巢癌患者生存期不足5年[3]。
在有效的治疗药物出现之前,很多卵巢癌患者被困在“化疗—复发—化疗”的恶性循环之中。显然,减少复发频频次,实现更长的无进展生存期,对于改善卵巢癌患者的预后和生存质量至关重要。
近日,我国晚期卵巢癌患者终于迎来了属于我们自己的“福星”。国家药品监督管理局(NMPA)正式批准恒瑞医药研发的1类新药、PARP抑制剂氟唑帕利胶囊(艾瑞颐®️)新适应症上市,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。

▲ NMPA批准页面截图
值得一提的是,氟唑帕利的获批是基于FZOCUS-1研究数据,这项完全基于中国卵巢癌患者的临床研究,也让氟唑帕利从获批开始就更懂、更适合中国卵巢癌患者。此外,这是我国自主研发的PARP抑制剂首次获批该适应症,也是氟唑帕利在卵巢癌获得的第三个适应症。
“氟”来居上
说起PARP抑制剂大家应该都不陌生了,毕竟PARP抑制剂的全球首批已经是10年前的事情了。
PARP的中文全称是多腺苷二磷酸核糖聚合酶,它发现于60年前[4]。作为一种DNA损伤后修复相关蛋白,PARP在识别到DNA上的单链断裂缺口后,会与DNA结合并激活PARP的催化活性;随后烟酰胺腺嘌呤二核苷酸(NAD+)会与PARP的活性位点结合,并招募DNA修复蛋白修复受损DNA[5]。在研究PARP功能的过程中,科学家还发现烟酰胺类似物不仅可以抑制DNA损伤的修复,还可以增强DNA损伤剂的细胞毒性[6]。
在人体细胞内,由PARP调控的DNA损伤修复机制,与由BRCA等蛋白主导的同源重组(HR)修复途径,构成功能互补的一对组合,共同维护细胞的基因组稳定性。2005年,《自然》杂志发表的两篇论文首次证实,抑制PARP的活性与BRCA1/2突变之间存在“合成致死”关系[7,8]。简单来说,PARP和BRCA调控的DNA损伤修复通路都无法正常工作了,细胞也就活不成了。
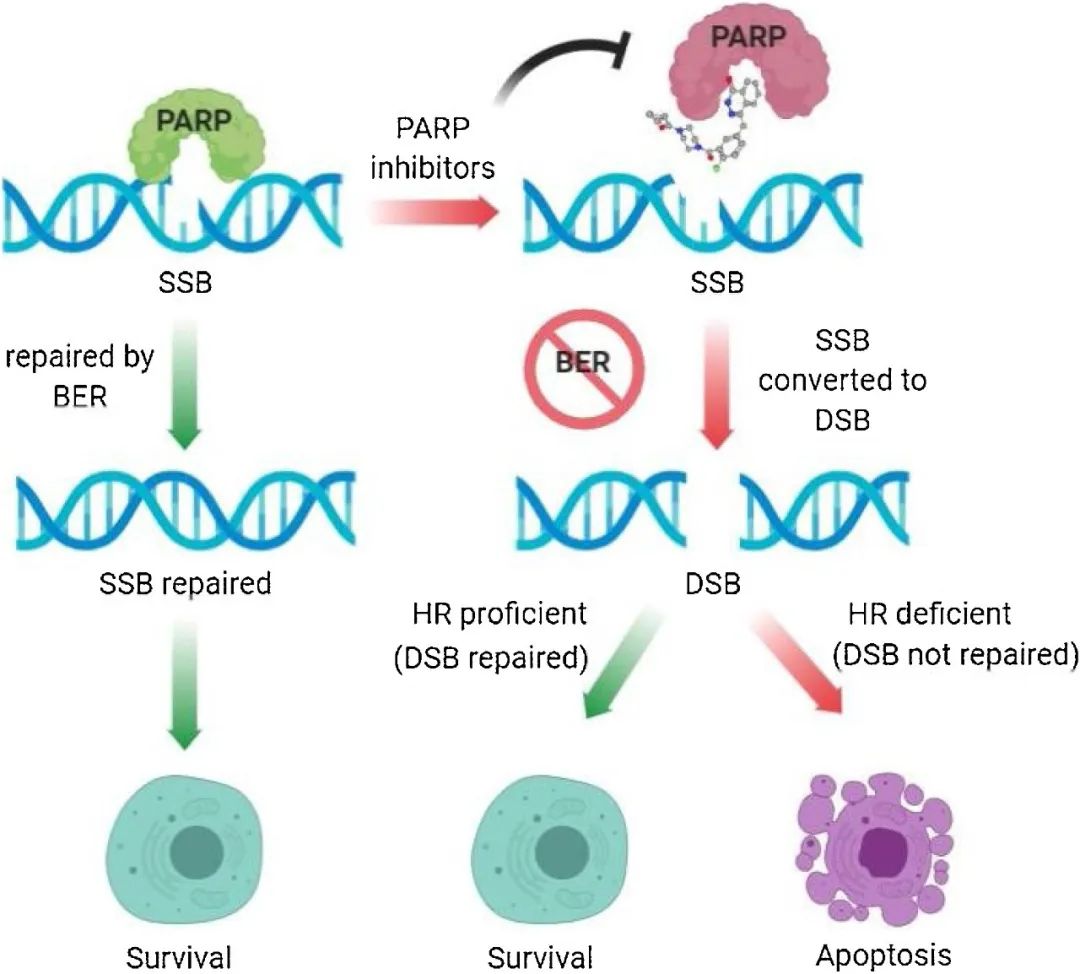
▲ PARP抑制剂作用机制
以上研究的研究成果指出了一个抗癌新方向:开发一种与NAD+竞争的药物在PARP活性位点与其竞争。在这个方向的指导下,PARP抑制剂也就此诞生了。仔细观察已经获得批准的PARP抑制剂不难发现,它们均具有与NAD+相似的烟酰胺结构,可竞争性结合PARP的活性中心;在侧链R基团上,不同PARP抑制剂存在非常大的差异,而这种差异可能就是影响药物吸收、代谢、疗效与安全性的关键。
与其他PARP抑制剂相比,氟唑帕利最独特的地方是在R基团中引入了三氟甲基结构。之所以在PARP抑制剂中引入氟,是因为恒瑞医药的研究人员发现,尽管同类PARP抑制剂有着不错的药效,但在稳定性上还有提升的空间。为了进一步改善药物分子在人体内的稳定性,研究人员打算引入氟。
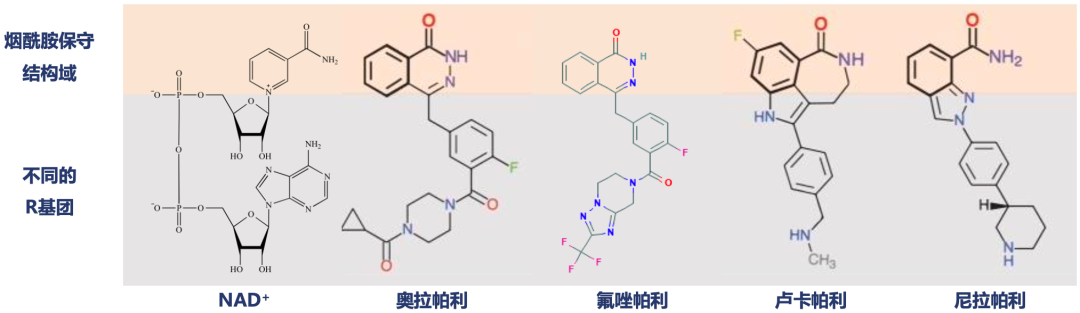
▲ 不同PARP抑制剂的结构差异
从理论上讲,氟原子或含氟基团的引入可以调节药物的理化特性,改变小分子的药代动力学性质,提高药物的生物利用度;还可以通过影响化合物的构象,增强药物与靶蛋白的结合能力及选择性;此外,还可以通过阻断易代谢位点提高药物代谢稳定性等[10]。
实际上,含氟药物在临床上的使用有近70年的历史了。早在1955年,美国FDA就批准了第一个人工合成的氟化药物9α-氟代皮质类固醇氟氢可的松[11]。到1957年,第一个含氟抗癌药5-氟尿嘧啶出现,氟在药物设计中的应用越来越受到重视。
关于氟化抗癌药物最经典的一对药物是索拉非尼和瑞戈非尼,这两个药物仅仅相差一个氟原子,但是它们的活性和治疗效果却表现出天差地别[12]。
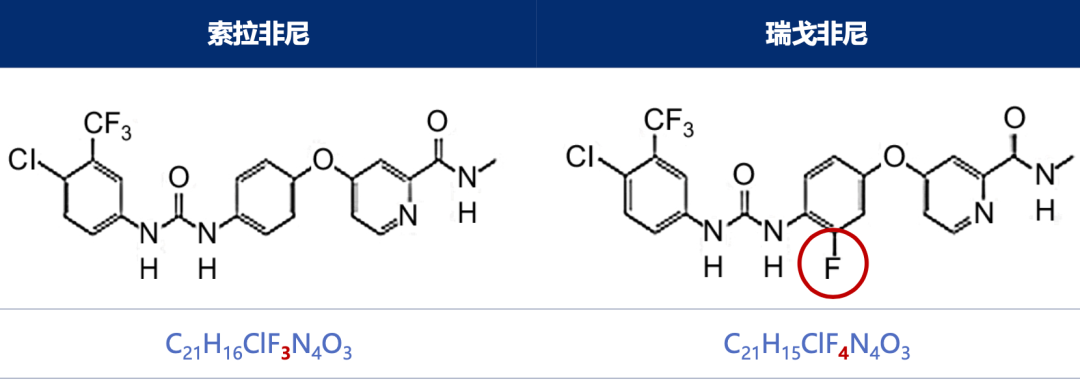
▲ 索拉非尼和瑞戈非尼的结构差异
与索拉非尼仅抑制肿瘤细胞增殖和血管生成不同,瑞戈非尼可以靶向参与血管生成、促进肿瘤生长和肿瘤微环境信号通路相关的多种激酶,包括VEGFR1/2/3、PDGFR-β和FGFR1等,而且对这些激酶的抑制活性也比索拉非尼更强[13]。
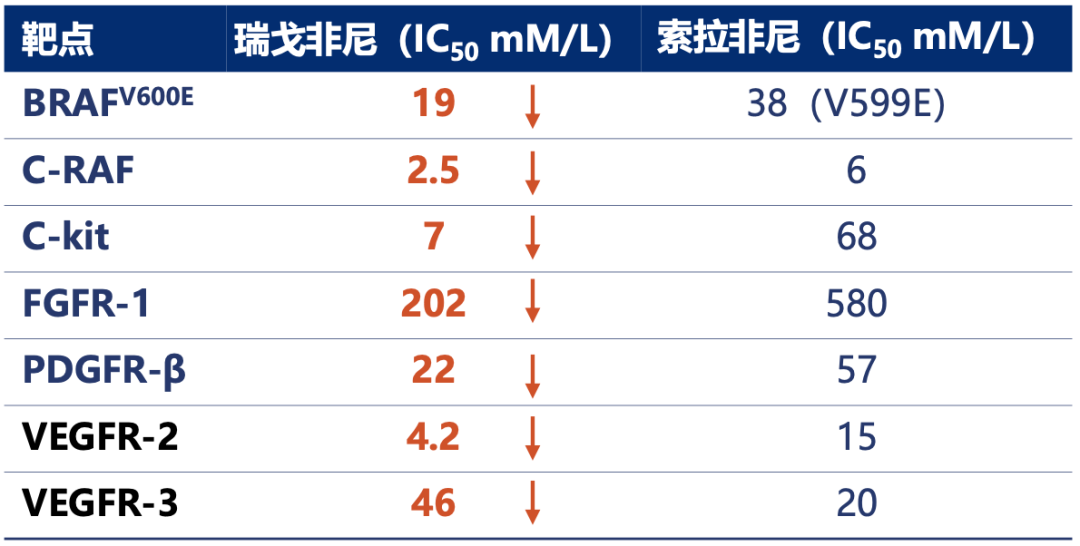
▲ 索拉非尼和瑞戈非尼的活性比较[14]
更重要的是,虽然仅增加了一个氟原子,但是瑞戈非尼却克服了索拉非尼的耐药问题即瑞戈非尼对索拉非尼治疗失败的肝癌患者有效并成为肝癌二线首选药物,同时还获批治疗结直肠癌和胃肠道间质瘤,成功拓宽了适应症。
与瑞戈非尼类似,三氟甲基的引入,给氟唑帕利带来的变化也是巨大的。从氟唑帕利的药代动力学数据来看,与其他PARP抑制剂相比,氟唑帕利对细胞的IC50值更低,说明对肿瘤细胞的杀伤性更强;氟唑帕利的稳态血药浓度的峰值(Cmax)更高,这与药物的易吸收性有一定的关系;而且氟唑帕利的瘤内与血浆药物暴露量比值更高,这是引入氟带来的脂溶性增强使得它的组织渗透性提升。此外,值得一提的是,氟唑帕利的血药浓度变异系数(CV)低于其他PARP抑制剂,这也说明氟唑帕利的稳态血药浓度个体差异小,在不同的患者体内表现可能更稳定。
在临床前的研究中,研究人员也发现,与结构类似的奥拉帕利相比,氟唑帕利在肿瘤异种模型中的抗肿瘤活性更高[15]。
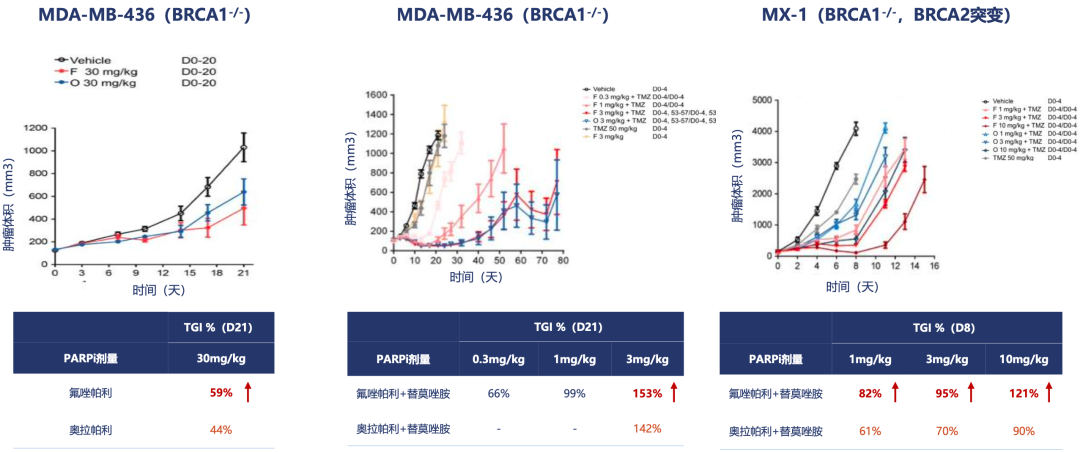
▲ 氟唑帕利的抗肿瘤活性更高
以上内容说明,引入三氟甲基不仅改变了氟唑帕利的药代动力学特征,也增强了它在临床前研究中的抗肿瘤活性。让人感到欣喜的是,这种“氟来居上”的优势,也转化成了临床获益。
“氟”星高照
氟唑帕利的首次华丽亮相是在2020年。
那一年9月份,恒瑞医药宣布由中国医学科学院肿瘤医院吴令英教授领衔的FZOCUS-3研究(当时的研究编号是FZPL-II-OC)达到主要研究终点[16],同年12月,NMPA就批准氟唑帕利用于治疗既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌。
▲ FZOCUS-3研究的PFS
FZOCUS-3研究中的首战告捷,让卵巢癌患者对氟唑帕利充满了期待,让人没想到的是,氟唑帕利的FZOCUS-2研究交出的答卷堪称惊艳。启动于2019年的多中心、随机、双盲、安慰剂对照的3期临床试验FZOCUS-2也是由吴令英教授领衔,国内的36个研究单位参与了研究,探索氟唑帕利用于铂敏感的复发性卵巢癌维持治疗的有效性和安全性[17]。
最终,FZOCUS-2研究的阳性结果也让氟唑帕利在2021年6月被NMPA批准用于铂敏感复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。
FZOCUS-2/3研究的成功,为氟唑帕利夺得晚期卵巢癌一线维持治疗这个“圣杯”奠定了坚实的基础。在2020年,吴令英教授等人又发起了FZOCUS-1研究,与前两个研究不同,这个随机、双盲、安慰剂对照、多中心的3期临床研究创造性地设置了三个研究组:氟唑帕利单药组、氟唑帕利联合阿帕替尼组、安慰剂组。研究目的是评估氟唑帕利单药或氟唑帕利联合阿帕替尼用于晚期卵巢癌一线含铂化疗缓解后维持治疗的有效性和安全性[18]。
研究一共纳入了674例新诊断的国际妇产科联盟(FIGO)III/IV期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,她们接受过肿瘤细胞减灭术联合6-9个周期的一线含铂化疗且达到完全/部分缓解,然后再以2:2:1的比例随机分至上面三组。研究的主要研究终点是由BIRC根据RECIST v1.1标准评估的全人群及gBRCA1/2突变人群的PFS。
在今年3月份召开的第55届美国妇科肿瘤学会(SGO)年会上,吴令英教授团队公布了FZOCUS-1研究中氟唑帕利单药组和安慰剂组的研究数据[18]。两组的中位随访时间分别为21个月和20.8个月。从BIRC评估的全人群PFS数据来看,氟唑帕利单药组数据未成熟(95% CI: 22.1-NR),而安慰剂组的这一数据为11.1个月(95% CI: 8.3-16.6),显然氟唑帕利的维持治疗显著改善了全人群的PFS(HR=0.49),将卵巢癌患者的疾病进展/死亡风险降低了51%。类似地,携带gBRCA突变的患者获益更大,卵巢癌患者的疾病进展/死亡风险降低了60%。
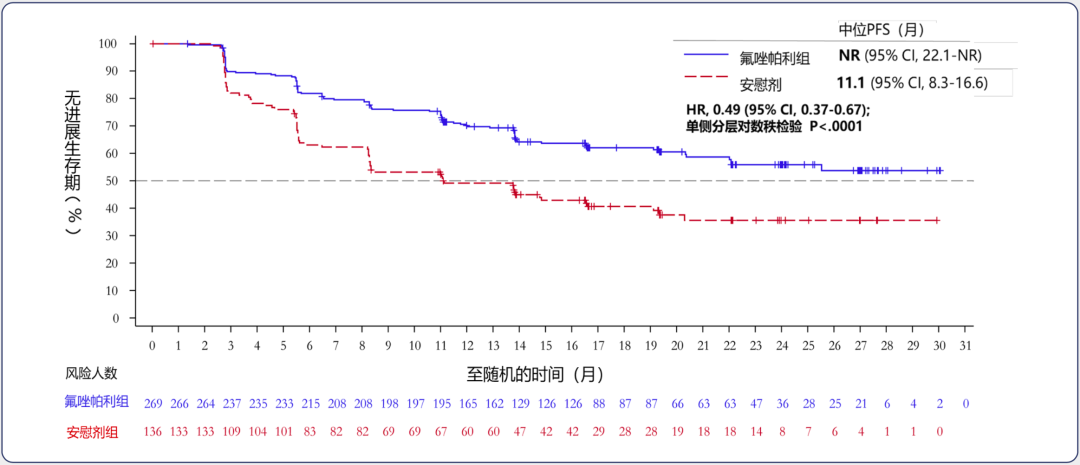
▲ FZOCUS-1研究的PFS获益
在安全性方面,总体来说安全性可控,未发现新的安全性信号。因TRAE导致的停药比例仅为0.7%,与之前的研究保持一致;且中期数据显示在治疗期间未发生骨髓增生异常综合征、急性髓系白血病或与治疗相关的死亡事件。
基于以上研究结果,吴令英教授团队认为,对于新确诊的晚期卵巢癌患者而言,在对一线含铂化疗有应答后,使用氟唑帕利单药作为维持治疗药物可显著改善患者的PFS,且安全性可控。因此,FZOCUS-1研究支持将氟唑帕利作为上述适应症的一种新的治疗选择。本次NMPA批准氟唑帕利的一线维持治疗正是基于FZOCUS-1研究的这一数据。
实际上,在氟唑帕利获批卵巢癌的一线维持治疗前,已经有两个进口药物在国内获批这一适应症,它们分别是奥拉帕利和尼拉帕利。其中,奥拉帕利基于国际研究SOLO-1的数据[19],获批的是BRCA突变晚期卵巢癌患者的一线维持治疗;尼拉帕利基于国际研究PRIMA的数据[20],获批的是一线含铂化疗完全或部分缓解的上皮性卵巢癌、输卵管癌或原发性腹膜卵巢癌成人患者维持治疗(去年围绕中国患者展开的PRIME研究数据也发布了[21])。
虽然上述两个进口PARP抑制剂已经进入我国临床实践,但是我国患者仍迫切需要更多可供选择的PARP抑制剂。作为我国首款自主研发的PARP抑制剂,氟唑帕利从研发之初就从服务于中国患者的角度出发,开展的FZOCUS-1/2/3研究均围绕中国卵巢癌患者,因此研究结果更适合中国卵巢癌患者。
总的来说,三氟甲基的引入,让氟唑帕利无论是在药代动力学,抗肿瘤活性,还是临床疗效上,都拥有了“氟”来居上的优势。
无论如何,希望氟唑帕利这个由我国自主研发的“福星”,能照耀更多我国晚期卵巢癌患者,并给她们带来更好的生存获益。
参考文献:
[1].Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-263. doi:10.3322/caac.21834
[2].Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022[J]. Journal of the National Cancer Center, 2024. doi:10.1016/j.jncc.2024.01.006
[3].Li N, Liu Q, Tian Y, Wu L. Overview of fuzuloparib in the treatment of ovarian cancer: background and future perspective. J Gynecol Oncol. 2022;33(6):e86. doi:10.3802/jgo.2022.33.e86
[4].CHAMBON P, WEILL JD, MANDEL P. Nicotinamide mononucleotide activation of new DNA-dependent polyadenylic acid synthesizing nuclear enzyme. Biochem Biophys Res Commun. 1963;11:39-43. doi:10.1016/0006-291x(63)90024-x
[5].Lord CJ, Ashworth A. PARP inhibitors: Synthetic lethality in the clinic. Science. 2017;355(6330):1152-1158. doi:10.1126/science.aam7344
[6].Durkacz BW, Omidiji O, Gray DA, Shall S. (ADP-ribose)n participates in DNA excision repair. Nature. 1980;283(5747):593-596. doi:10.1038/283593a0
[7].Bryant HE, Schultz N, Thomas HD, et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase [published correction appears in Nature. 2007 May 17;447(7142):346]. Nature. 2005;434(7035):913-917. doi:10.1038/nature03443
[8].Farmer H, McCabe N, Lord CJ, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 2005;434(7035):917-921. doi:10.1038/nature03445
[9].Zheng F, Zhang Y, Chen S, Weng X, Rao Y, Fang H. Mechanism and current progress of Poly ADP-ribose polymerase (PARP) inhibitors in the treatment of ovarian cancer. Biomed Pharmacother. 2020;123:109661. doi:10.1016/j.biopha.2019.109661
[10].王江,柳红.氟原子在药物分子设计中的应用[J].有机化学, 2011, 31(11):1785-1798.DOI:10.6023/cjoc1202132.
[11].Meanwell NA. Fluorine and Fluorinated Motifs in the Design and Application of Bioisosteres for Drug Design. J Med Chem. 2018;61(14):5822-5880. doi:10.1021/acs.jmedchem.7b01788
[12].Miura K, Satoh M, Kinouchi M, et al. The preclinical development of regorafenib for the treatment of colorectal cancer. Expert Opin Drug Discov. 2014;9(9):1087-1101. doi:10.1517/17460441.2014.924923
[13].Liu S, Du Y, Ma H, Liang Q, Zhu X, Tian J. Preclinical comparison of regorafenib and sorafenib efficacy for hepatocellular carcinoma using multimodality molecular imaging. Cancer Lett. 2019;453:74-83. doi:10.1016/j.canlet.2019.03.037
[14].Ravi S, Singal AK. Regorafenib: an evidence-based review of its potential in patients with advanced liver cancer. Core Evid. 2014;9:81-87. Published 2014 Jul 17. doi:10.2147/CE.S48626
[15].Wang L, Yang C, Xie C, et al. Pharmacologic characterization of fluzoparib, a novel poly(ADP-ribose) polymerase inhibitor undergoing clinical trials. Cancer Sci. 2019;110(3):1064-1075. doi:10.1111/cas.13947
[16].Li N, Bu H, Liu J, et al. An Open-label, Multicenter, Single-arm, Phase II Study of Fluzoparib in Patients with Germline BRCA1/2 Mutation and Platinum-sensitive Recurrent Ovarian Cancer. Clin Cancer Res. 2021;27(9):2452-2458. doi:10.1158/1078-0432.CCR-20-3546
[17].Li N, Zhang Y, Wang J, et al. Fuzuloparib Maintenance Therapy in Patients With Platinum-Sensitive, Recurrent Ovarian Carcinoma (FZOCUS-2): A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Phase III Trial. J Clin Oncol. 2022;40(22):2436-2446. doi:10.1200/JCO.21.01511
[18].https://sgo.planion.com/Web.User/AbstractDet?ACCOUNT=SGO&ABSID=440521&CONF=AM2024&CKEY=
[19].Moore K, Colombo N, Scambia G, et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2018;379(26):2495-2505. doi:10.1056/NEJMoa1810858
[20].González-Martín A, Pothuri B, Vergote I, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019;381(25):2391-2402. doi:10.1056/NEJMoa1910962
[21].Li N, Zhu J, Yin R, et al. Treatment With Niraparib Maintenance Therapy in Patients With Newly Diagnosed Advanced Ovarian Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2023;9(9):1230-1237. doi:10.1001/jamaoncol.2023.2283
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


