Cancer Cell:邵志敏/江一舟/杨文涛/李俊杰团队开发AI模型,精准预测ADC药物的乳腺癌治疗效果
来源:生物世界 2025-04-13 13:27
该研究通过 AI 模型结合肿瘤微环境空间特征,精准预测了新一代 ADC 药物 SHR-A1811 在 HER2+ 乳腺癌新辅助治疗中的效果,为乳腺癌的个性化治疗提供了全新导航图。
乳腺癌是全球女性中最常见的癌症类型,也是导致女性癌症相关死亡的主要原因之一。人表皮生长因子受体 2 阳性(HER2+)乳腺癌,约占所有乳腺癌病例的 15%-20%,其特征是 HER2 蛋白过度表达,且与肿瘤侵袭性强和预后不良相关。
抗体药物偶联物(ADC)如同"生物导弹",通过抗体精准识别肿瘤细胞,进而释放高效化疗药物杀伤肿瘤细胞。新一代 ADC 药物 SHR-A1811(一款抗 HER2 ADC 药物)虽显著提升了疗效,但仍有部分患者响应不佳或产生副作用。因此,我们迫切需要疗效相关生物标志物和预测工具来指导这些新型 ADC 药物的精准应用,避免 ADC 药物“误伤”健康组织,实现精准打击。
2025 年 4 月 10 日,复旦大学附属肿瘤医院邵志敏、江一舟、杨文涛、李俊杰等人在 Cancer Cell 期刊发表了题为:Spatial determinants of antibody-drug conjugate SHR-A1811 efficacy in neoadjuvant treatment for HER2-positive breast cancer 的研究论文。
该研究通过 AI 模型结合肿瘤微环境空间特征,精准预测了新一代 ADC 药物 SHR-A1811 在 HER2+ 乳腺癌新辅助治疗中的效果,为乳腺癌的个性化治疗提供了全新导航图。

近年来,靶向 HER2 的治疗手段取得了进展,例如单克隆抗体、酪氨酸激酶抑制剂(TKI)以及抗体药物偶联物(ADC),这些疗法显著改善了此类乳腺癌患者的治疗效果,使其成为一种更易控制的乳腺癌亚型。
最近,新一代 ADC 药物,通过优化连接子(linker)和选择有效载荷,进一步提高了其靶向特异性和治疗效果。ADC 药物的迅速发展和创新潜力凸显了其在 HER2+ 乳腺癌未来治疗中的关键作用。
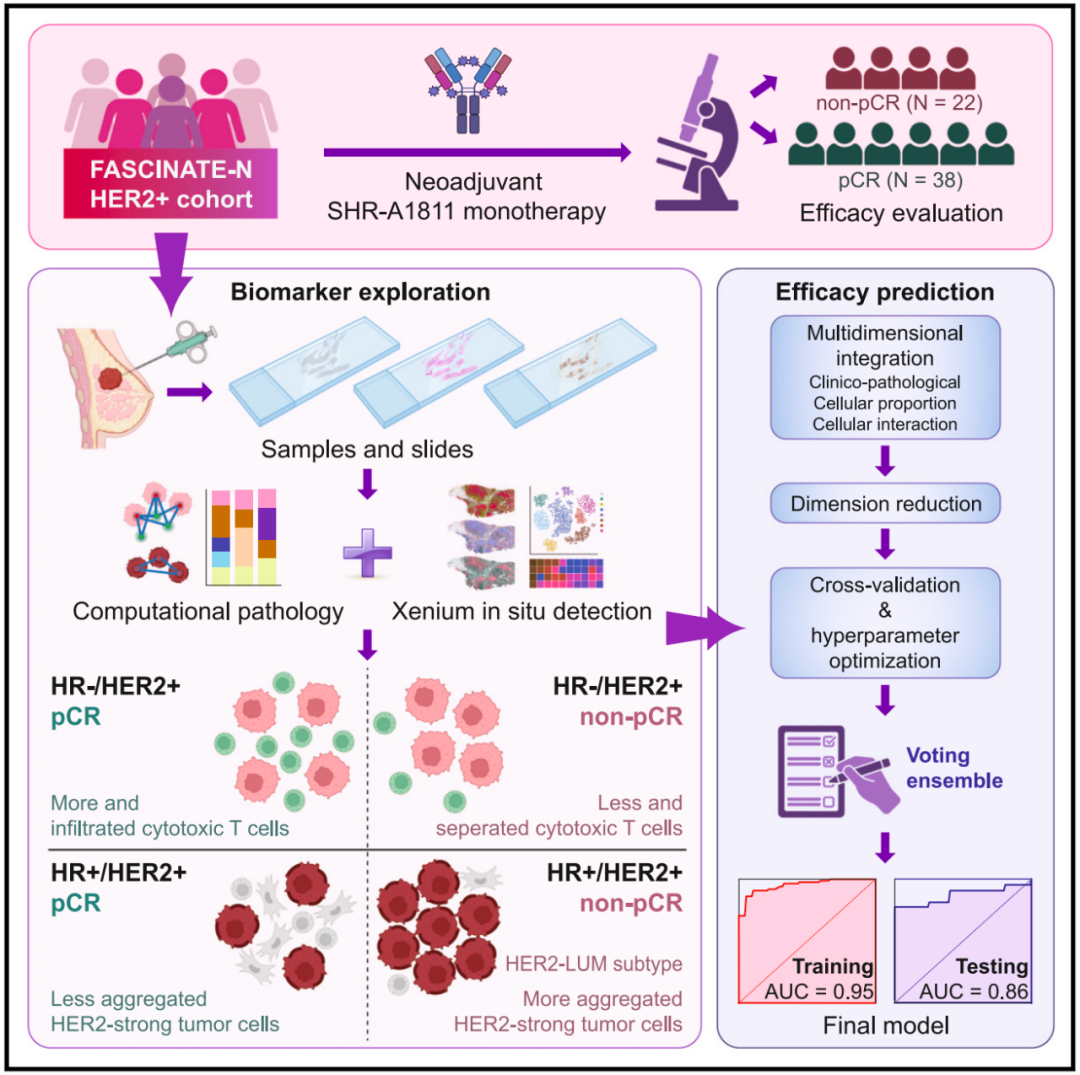
为解决在 HER2+ 乳腺癌治疗中精准使用新型抗 HER2 ADC 药物的难题,研究团队基于他们之前的 2 期 FASCINATE-N 临床试验中的 HER2+ 乳腺癌队列开展了一项转化研究。FASCINATE-N 试验为优化新辅助治疗方案搭建了平台,并为源自临床试验的转化研究提供了长期、稳定的支撑。FASCINATE-N 试验的 HER2+ 乳腺癌队列包括被随机分组的患者,分别接受 8 个周期的 SHR-A1811 新辅助治疗方案和 6 个周期的标准 PCbHP 治疗方案。
临床试验已证实新型 ADC 药物的有效性,以 T-DXd(一款抗 HER2 ADC 药物)为例,其在 HER2+、HER2 低表达和 HER2 极低表达的肿瘤中均取得了显著疗效。然而,仍有相当数量的患者无法从该药物的治疗中获益,而且这些 ADC 药物存在“过度应用”的潜在风险,这引发了对其不当使用的担忧,可能会增加严重副作用的发生(例如使人衰弱的肺毒性)。因此,迫切需要与疗效相关的生物标志物和预测工具来指导这些新型 ADC 药物的精准应用。
SHR-A1811 是由恒瑞医药开发的第三代抗 HER2 ADC 药物,由可裂解的连接子、曲妥珠单抗和新型拓扑异构酶 I 抑制剂(SHR9265)三部分构成,其药物抗体比(DAR)为 5.7。
值得注意的是,在此前的研究中,SHR-A1811 对 HER2 表达的乳腺癌显示出良好的疗效,在晚期 HER2+ 乳腺癌中的客观缓解率为 76.3%,在 HER2 低表达乳腺癌中的客观缓解率为 60.4%,使其成为研究新型抗 HER2 ADC 药物的理想方案。
在这项最新研究中,研究团队旨在探究与新辅助 SHR-A1811 治疗敏感性相关的独特患者特征,以期指导这种新型抗 HER2 ADC 药物的精准临床应用。为实现这一目标,研究团队整合了临床和生物学证据,利用了 bulk 测序数据,以及团队已发表的算法处理计算病理学以及原位空间成像技术。
基于这些见解,研究团队开发了一种临床实用且易于解释的基于人工智能(AI)的预测模型,用于预测 SHR-A1811 的疗效,该模型也可外推至其他新型 HER2 靶向的 ADC 药物。通过利用这种结构化且全面的研究框架,研究团队旨在优化 SHR-A1811 的个性化治疗策略,为 HER2+ 乳腺癌患者提供精准的治疗指导。
研究团队对 60 例接受 SHR-A1811 新辅助治疗的患者进行多维度分析,结果发现:在激素受体(HR)阴性亚组中,更高比例和更多的免疫细胞(即肿瘤浸润淋巴细胞)浸润,特别是细胞毒性 T 细胞,与更好的治疗反应相关。在 HR 阳性亚组中,HER2 强阳性肿瘤细胞的紧密性和聚集性(而不是均匀分布)与较低的反应率和 HER2-LUM 亚型(更接近于 HR+/HER2乳腺癌)有关。
在上述发现的基础上,研究团队开发出了一种临床级预测 AI 模型,整合三大维度:
临床特征:肿瘤分期、激素受体状态;
数字病理:HER2 表达模式、免疫/基质细胞空间布局;
拓扑网络:细胞间连接距离、细胞群结构。
模型表现:在训练集准确率为 95 %,真实世界验证准确率为 86%,显著优于传统评估。特异性验证显示,对非 ADC 治疗方案(例如PCbHP)预测无效,彰显技术独特性。
因此,这款 AI 模型能够根据临床病理特征和病理图像(无需基因检测)即可预测 SHR-A1811 以及其他新型 ADC 药物的新辅助治疗反应。
该研究的核心发现:
基于空间的生物标志物可反映抗 HER2 ADC 药物新辅助治疗的反应;
在激素受体阴性(HR-)乳腺癌中,肿瘤浸润淋巴细胞(特别是细胞毒性 T 细胞)越多,与病理完全缓解(pCR)的相关性越强;
HER2 强阳性肿瘤细胞聚集与 HR+ 乳腺癌患者未达病理完全缓解相关;
AI 模型预测了新一代 ADC 药物 SHR-A1811 在 HER2+ 乳腺癌新辅助治疗中的获益情况。
这项研究有望改写 HER2+ 乳腺癌的治疗范式,通过解码肿瘤的空间生物学特征,让乳腺从“粗放式治疗”迈向“细胞级精准医疗”。未来结合术中快速检测技术,有望实现治疗方案的实时定制。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


