《癌细胞》:看“纤维”,知好坏!科学家提出基于癌症相关成纤维细胞评估肺癌患者预后的新方法
来源:奇点糕 2024-02-02 11:00
基于既往对乳腺癌等实体瘤中CAFs特征的研究和分型经验[2-3],苏黎世大学团队使用成像型质谱流式细胞分析(IMC)和RNA单细胞测序,评估了1070例NSCLC患者的CAFs表型特点。
近日,瑞士苏黎世大学研究者们在Cancer Cell期刊发表了最新研究成果,提出以微环境中CAFs表型特征,将非小细胞肺癌(NSCLC)分为四种预后不同的亚型,其中肿瘤样CAF(tCAF)和间质CAF(mCAF)两类均提示预后不佳,而炎症型CAF(iCAF)和干扰素应答CAF(ifnCAF)两类亚型则预后较好[1]。
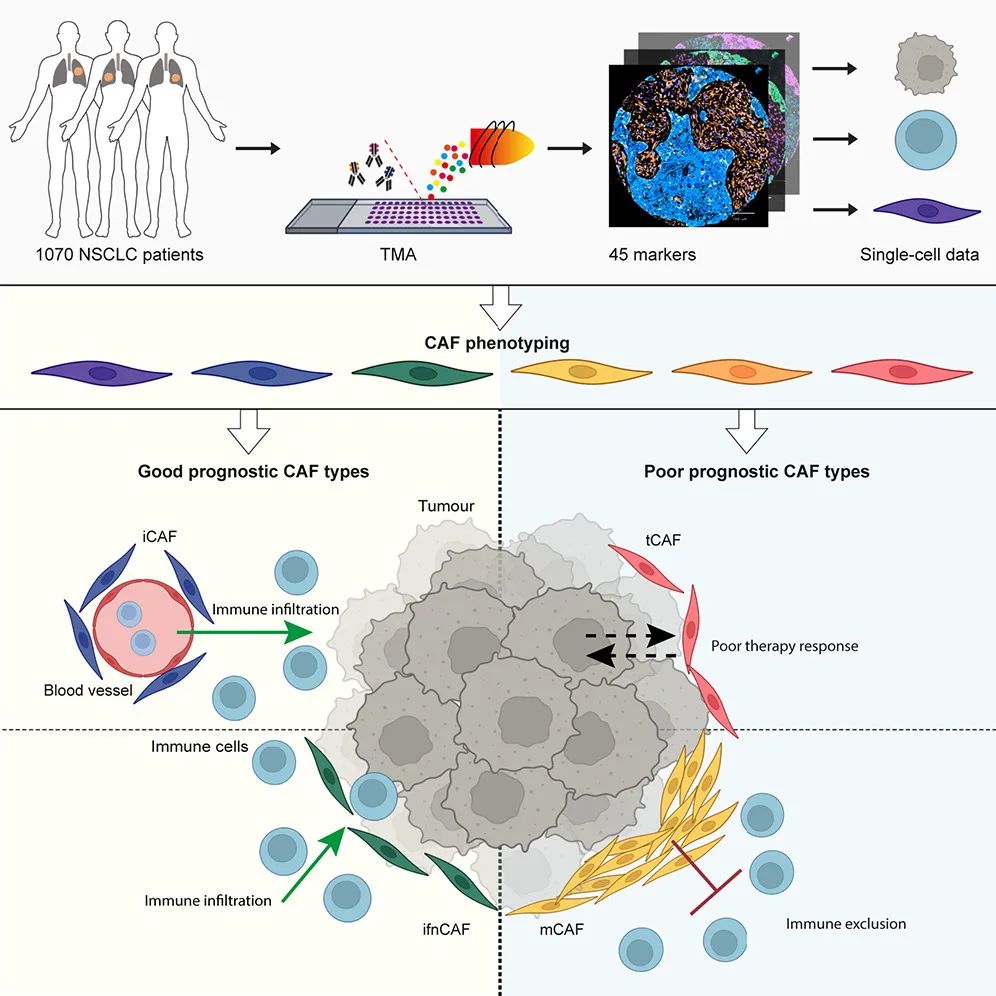
论文核心内容总结
虽说在奇点糕们介绍的研究里,CAFs大多是促癌的反派角色,比如前段时间提到的肿瘤相关肌成纤维细胞(myCAFs),但CAFs毕竟是个有很强异质性的群体,其中不乏可以增强抗肿瘤免疫、协助机体抑癌的亚群[2]。开发治疗策略时,要针对不利于抗癌的CAFs亚群;而从评估预后的角度出发,就得衡量患者CAFs的整体特征,看看正反派的力量几几开了。
基于既往对乳腺癌等实体瘤中CAFs特征的研究和分型经验[2-3],苏黎世大学团队在此次研究中,仍主要使用成像型质谱流式细胞分析(IMC)和RNA单细胞测序,评估了1070例NSCLC患者的CAFs表型特点,这些患者绝大多数为分期I-II期的早期NSCLC初治患者,且中位随访时间长达15年,足以提供疾病复发(随访期内复发率约45%)和预后相关资料。
在抗体标记、IMC分析等一系列处理后,研究者们获取了足以定义NSCLC肿瘤内CAFs表型特征,以及微环境内内皮细胞、上皮细胞及T细胞等免疫细胞特点的数据,并评估CAFs亚型存在与否和患者临床结局的相关性,为后续的分型奠定基础。
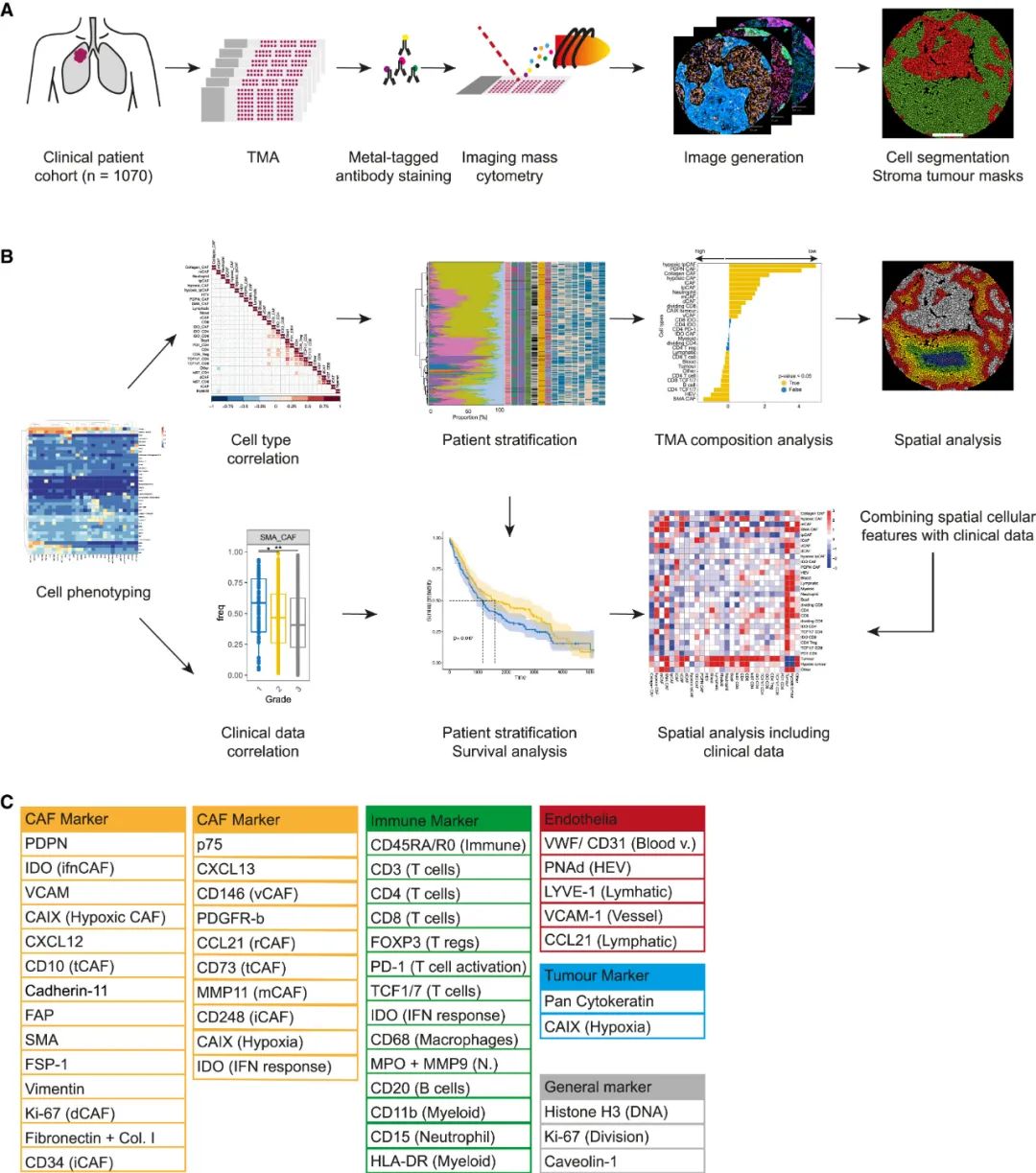
研究简要流程及方法论
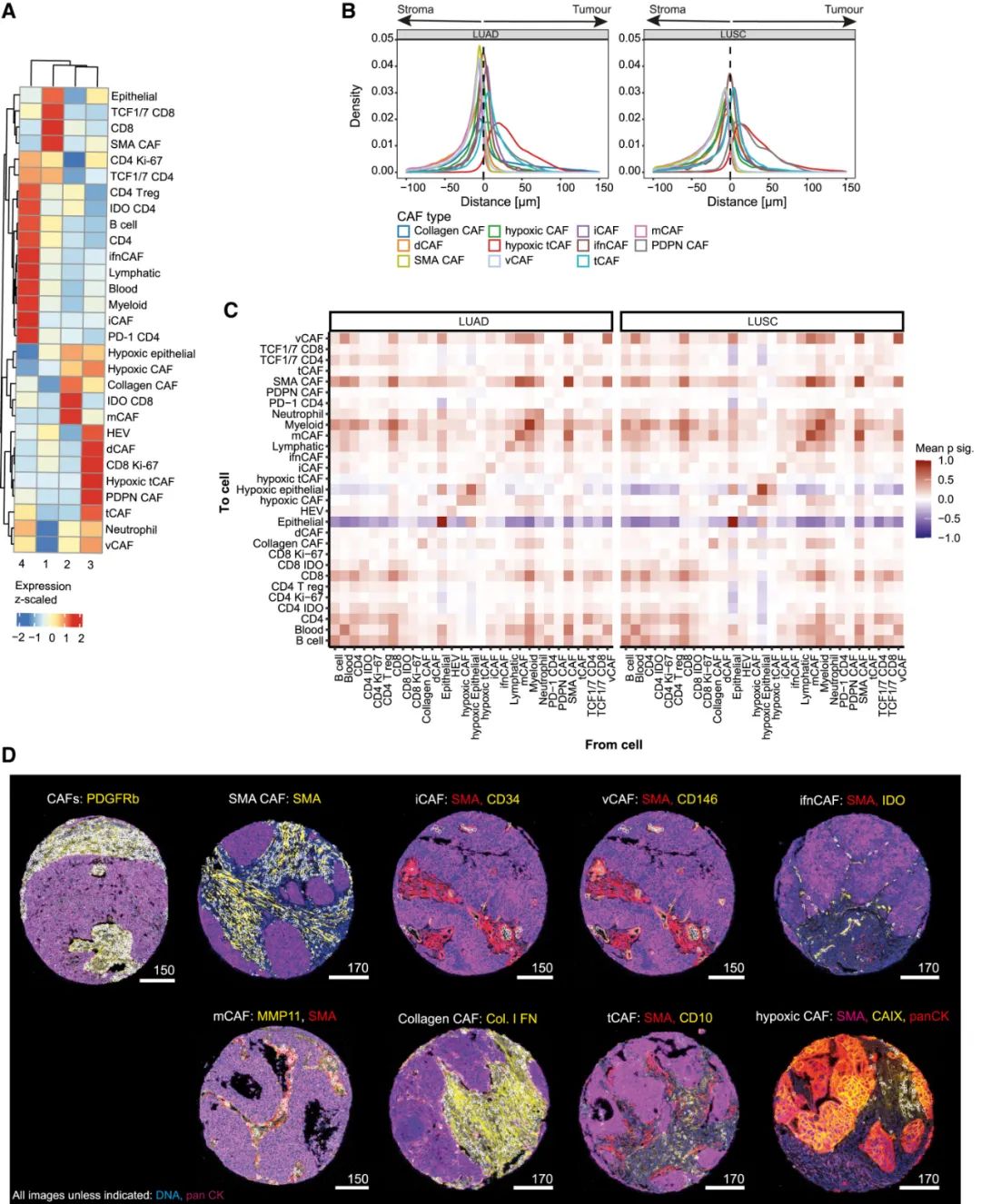
研究者们将NSCLC微环境中存在的CAFs划分出了11个亚型,绝大多数都与其它实体瘤存在的CAF亚型对应,其中在本文开头提到的四类CAFs具体特征如下:肿瘤样CAF(tCAF)特征为CD10+/CD73+、干扰素应答CAF(ifnCAF)为IDO+、炎症型CAF(iCAF)为CD34+/CD248+、间质CAF(mCAF)则为MMP11+/SMA+/胶原+。分析还显示,肺腺癌和鳞癌中的CAFs富集特征也明显不同,如mCAF在鳞癌中就更多见。
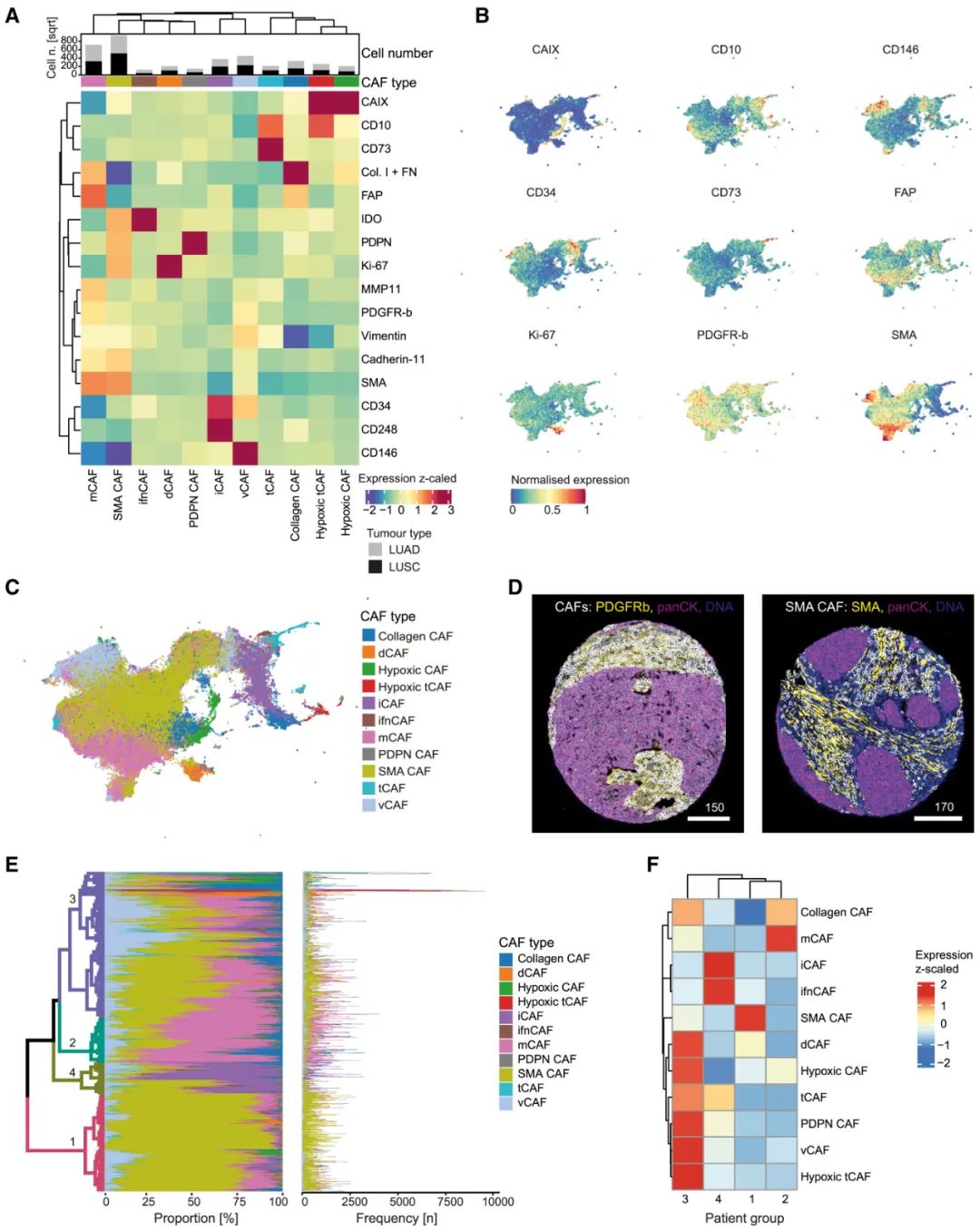
NSCLC中的CAFs表型特征汇总
基于不同亚型CAFs的分布状况,所有患者可以被分为4组,而这种基于CAFs的亚型划分,就与患者预后明确相关:肿瘤中iCAFs和ifnCAFs富集的患者,中位总生存期(OS)整体超过3年,而其它亚型CAFs富集大多与患者疾病复发、OS较短有关,可以说它们都不是好东西;且经肿瘤组织学类型、性别等因素调整后,CAFs表型特征仍是独立预后因子。
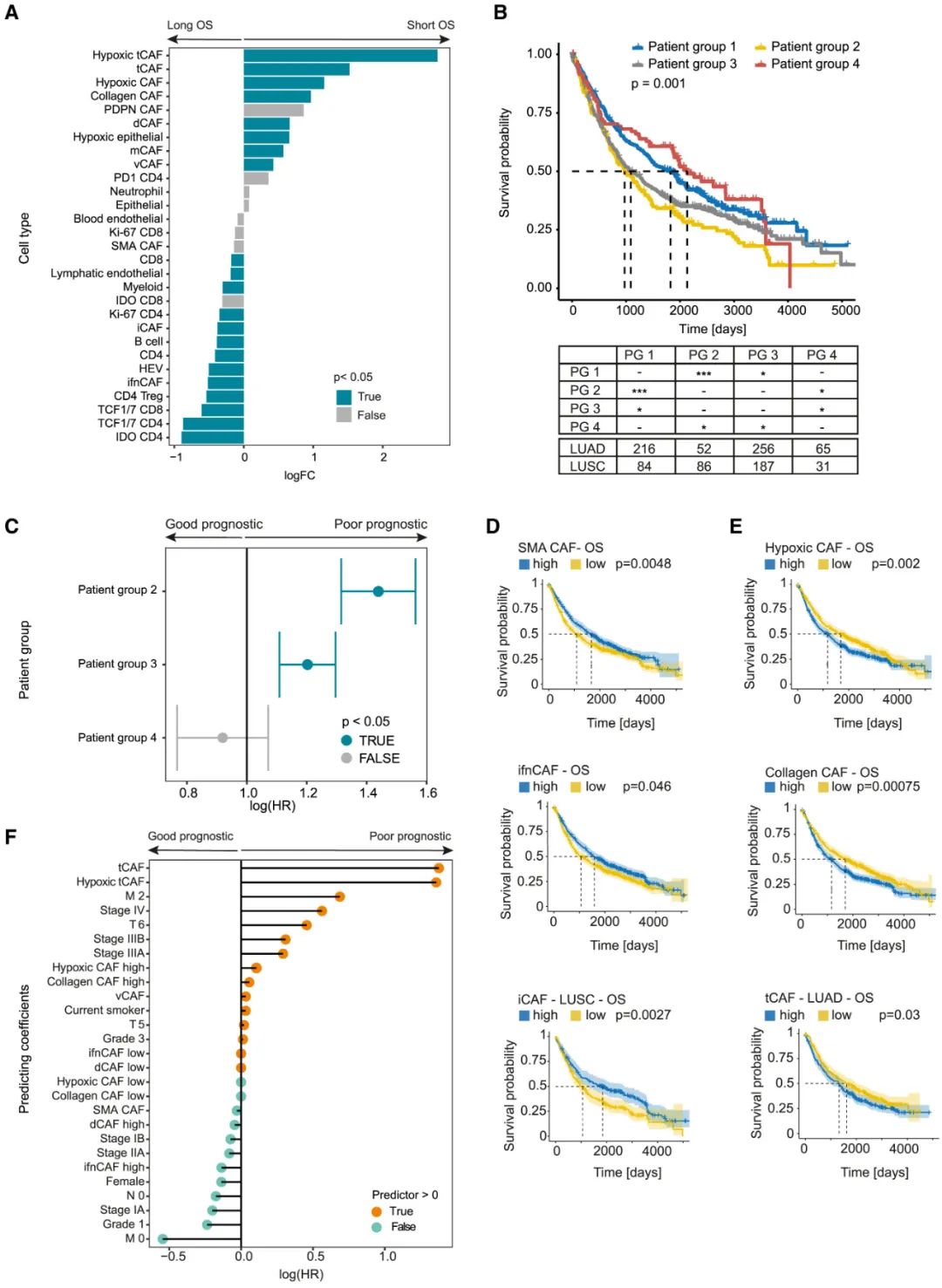
基于CAFs表型特征的亚型划分与患者生存预后的相关性
当然了,分析CAFs表型特征的价值还不止于此:研究者们进一步根据患者特征细化分析,发现在接受手术和辅助化疗的患者中,术后复发患者的CAFs表型特征也明显不同,腺癌中的tCAFs及胶原CAFs、鳞癌中的乏氧CAFs/tCAFs均与复发显著相关,与此类似,癌症淋巴结扩散和远处转移,也有各自显著相关的CAFs表型特征。
CAFs的表型特征,归根结底反映的是不同的肿瘤微环境状态:结合对其它免疫细胞分布的评估,研究者们发现肿瘤中iCAFs和ifnCAFs富集,往往与肿瘤微环境呈炎症性、免疫细胞浸润较多且不乏氧有关,而tCAFs富集毫不意外地也和一大堆负面因素,例如调节性T细胞、髓系来源的免疫抑制细胞,以及各种免疫耗竭特征挂钩。
CAFs表型特征与肿瘤微环境整体特征的关系
最后,研究者们利用空间组学分析评估了不同CAFs在肿瘤中的分布特征,总结出了一些整体性规律,例如mCAFs几乎仅见于肿瘤间质部位,且它可能通过促进间质纤维化、抑制各类免疫细胞有效浸润来促癌;iCAFs和tCAFs多在肿瘤内部,而ifnCAFs大多位于肿瘤-间质接触界面(interface),且靠近同为IDO+的T细胞,提示了它们的主要影响对象。
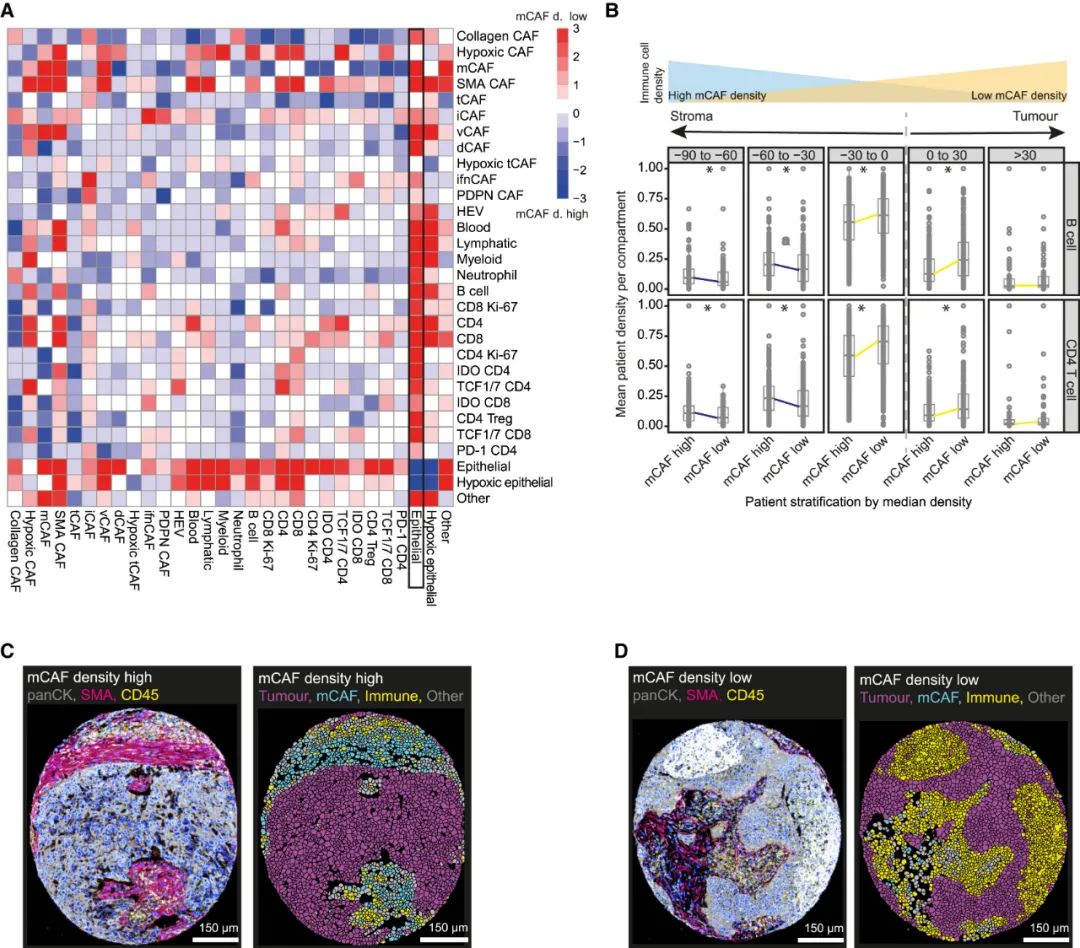
mCAFs促进纤维化以抑制其它免疫细胞向NSCLC中浸润
总而言之,本次研究提出以CAFs表型特征对NSCLC进行分型,对当前的临床诊治有一定的指导价值,但更大的应用前景或许还在前方,对于正在研发中、以CAFs为干预靶标的各种疗法,这可就是把打击目标都标明了。对鱼龙混杂的CAFs来个去芜存菁,打掉促癌亚群、扶植抑癌战友,尽量避免无差别打击,这才是正道嘛。
参考文献:
[1]Cords L, Engler S, Haberecker M, et al. Cancer-associated fibroblast phenotypes are associated with patient outcome in non-small cell lung cancer[J]. Cancer Cell, 2024.
[2]Grout J A, Sirven P, Leader A M, et al. Spatial positioning and matrix programs of cancer-associated fibroblasts promote T-cell exclusion in human lung tumors[J]. Cancer Discovery, 2022, 12(11): 2606-2625.
[3]Cords L, Tietscher S, Anzeneder T, et al. Cancer-associated fibroblast classification in single-cell and spatial proteomics data[J]. Nature Communications, 2023, 14: 4294.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


