李博文团队开发肿瘤定制LNP,递送IL-12 circRNA,增强肺癌免疫治疗
来源:生物世界 2024-05-03 09:16
这项研究不仅开创了一种新的基于circRNA的肺癌免疫疗法还引入了一种针对特定癌症类型的LNP定制方法,为个性化癌症纳米医学的发展铺平了道路。
多伦多大学李博文团队(Shufen Xu、Yue Xu为共同第一作者)在 Advanced Materials 期刊发表了题为:Tumor-Tailored Ionizable Lipid Nanoparticles Facilitate IL-12 Circular RNA Delivery for Enhanced Lung Cancer Immunotherapy 的研究论文。
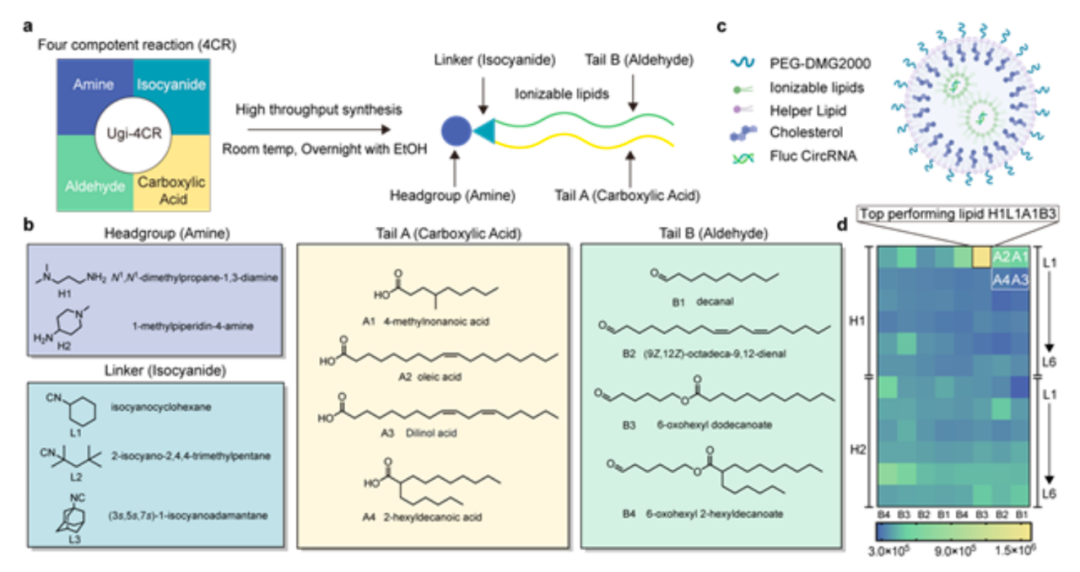
该研究利用高通量组合方法合成并筛选了能够高效将环形RNA(circRNA)递送至肺肿瘤的脂质纳米粒(LNP)——H1L1A1B3 LNP,其向肺癌细胞递送circRNA的效率比行业标准LNP(ALC-0315)提高了4倍,同时具有强大的免疫激活作用。H1L1A1B3 LNP递送的编码IL-12的circRNA在单次注射到肿瘤或气管内给药后,在肺癌小鼠模型中引发了强效的免疫反应,导致明显的肿瘤消退。这些结果突显了癌症治疗中定制LNP平台推进RNA药物递送的潜力,拓宽了RNA免疫疗法的前景。

由于IL-12在临床前研究中具有显著的抗肿瘤作用,多种IL-12疗法已进入肿瘤免疫治疗的临床试验。然而,全身给药相关的严重毒性已导致其中许多临床试验提前终止。因此,有一些研究正在探索减少IL-12系统暴露相关毒性,例如,使用脂质纳米颗粒(LNP)向肿瘤内递送IL-12的mRNA,还可以使用自复制mRNA来解决mRNA表达时间短,减少给药频率,但自复制mRNA也有一些明显不足,包括长度大导致的不稳定性和体内递送效率低,以及与碱基修饰相容性差带来的免疫原性。
环形RNA(circRNA)是细胞中广泛存在的一种共价闭合环形RNA分子,其独特的环形结构能够抵抗核酸外切酶的降解,从而提高了生物稳定性,其在体内具有比线性mRNA显著延长的半衰期,与未修饰的mRNA相比,纯化的circRNA还具有的较低的先天免疫激活,无需进行核苷修饰、5'帽子和3' Poly A尾巴来提高其安全性、翻译性和稳定性,使其成为一种更具成本效益的选择。
circRNA在癌症免疫治疗领域潜力显而易见,但其成功应用取决于递送系统的有效性。脂质纳米颗粒(LNP)是当前领先的递送mRNA的非病毒载体,LNP通常含有4种组分,其中可电离脂质对有效递送至关重要,可电离脂质的结构修饰显著影响mRNA递送效率,但没有一种可电离脂质结构可以普遍适用于所有目的。例如,针对肝脏或肌肉组织设计的LNP在其他组织中可能不同样有效。肿瘤组织具有低pH和低氧等特性,使用LNP向肿瘤组织中递送mRNA时面临独特挑战,与常氧条件下的细胞相比,低氧细胞通过LNP递送的mRNA表达水平降低。此外,肿瘤细胞的特性在不同的癌症类型中有所不同,这提示我们需要根据不同的癌症类型来定制LNP,以优化递送效率,提高基于mRNA的癌症免疫治疗效果。
在这项研究中,研究团队采用了一种高通量的方法来快速合成和评估多种可电离脂质库,特别是用于将circRNA递送到肺肿瘤,筛选结果显示,可电离脂质H1L1A1B3掺入LNP后,能够显著提高circRNA向LLC1肺癌细胞系中的转染效率,比辉瑞/BioNTech公司在mRNA新冠疫苗中使用的行业标准LNP(ALC-0315)提高了4倍。此外,H1L1A1B3 LNP因其激活NF-κB/IRF免疫途径的能力而值得注意。
在小鼠LLC1肺癌模型中,H1L1A1B3 LNP递送编码IL-12的circRNA,向肺肿瘤内单次给药可显著促进肿瘤环境中的免疫细胞浸润,并诱导肿瘤实质性消退。值得注意的是,H1L1A1B3-LNP还显示出将circRNA直接递送到肺部能力。在原位HKP1肺癌模型中,单次气管内给药H1L1A1B3-LNP递送的IL-12 circRNA,可有效抑制肺肿瘤生长。

总的来说,这项研究不仅开创了一种新的基于circRNA的肺癌免疫疗法还引入了一种针对特定癌症类型的LNP定制方法,为个性化癌症纳米医学的发展铺平了道路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


