研究揭示动脉粥样硬化发生新机制
来源:中山医学院 2021-10-21 22:24
近日,中山大学中山医学院梁思佳副教授、周家国教授和中山大学附属第一医院区景松教授团队合作在巨噬细胞泡沫化和动脉粥样硬化研究中取得进展。该研究结果发表在心血管研究权威期刊European Heart Journal上。该研究揭示了巨噬细胞NFATc3(活化T细胞核因子c3)通过上调miRNA-204抑制动脉粥样硬化形成的作用机理,发现胞浆miRNA-204-5
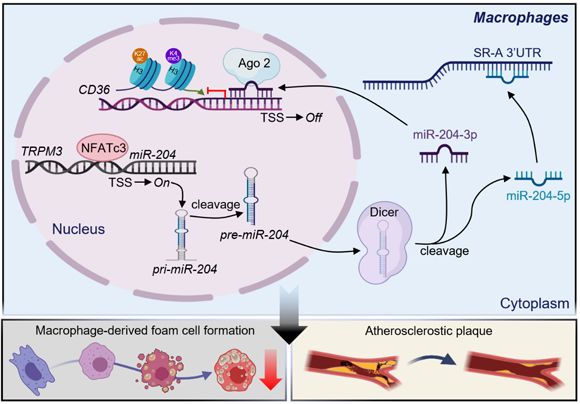
近日,中山大学中山医学院梁思佳副教授、周家国教授和中山大学附属第一医院区景松教授团队合作在巨噬细胞泡沫化和动脉粥样硬化研究中取得进展。该研究结果发表在心血管研究权威期刊European Heart Journal上。该研究揭示了巨噬细胞NFATc3(活化T细胞核因子c3)通过上调miRNA-204抑制动脉粥样硬化形成的作用机理,发现胞浆miRNA-204-5p靶向抑制SR-A,胞核miRNA-204-3p靶向抑制CD36,两者共同抑制巨噬细胞泡沫化和动脉粥样硬化。
动脉粥样硬化是一种炎症反应启动的脂质沉积性疾病,是多种心脑血管疾病的共同病理基础,由其所致的脑卒中,冠心病及心肌梗死等心脑血管事件严重危害人类健康。深入探讨动脉粥样硬化发病机制,寻找新防治靶点,对治疗动脉粥样硬化性心脑血管疾病具有重要的科学意义和价值。
该研究发现动脉粥样硬化斑块中巨噬细胞核中NFATc3表达降低。同时,循环外周血单核细胞中的 NFATc3 水平与动脉粥样硬化患者的疾病严重程度呈负相关。通过在体动物实验发现,巨噬细胞特异性敲除NFATc3可促进动脉粥样硬化发展,过表达NFATc3则抑制动脉粥样硬化形成,但并不影响血脂水平。机制分析发现NFATc3主要通过抑制清道夫受体SR-A和CD36的表达,进而抑制巨噬细胞的脂质沉积和泡沫化。有趣的是,NFATc3作为转录因子并不直接与SR-A和CD36基因启动子区结合调控其表达。鉴于miRNA能抑制靶基因的表达,研究者推测NFATc3可能通过调控miRNA表达抑制SR-A和CD36的水平。通过多组学综合分析发现NFATc3能够明显上调miR-204-5p和miR-204-3p的表达。通过荧光素酶实验和启动子序列缺失实验分析检测到NFATc3结合在miR-204基因进化保守位点上游-1.5 kb处,并靶向调节miR-204的转录,且miR-204能抑制巨噬细胞的脂质沉积和泡沫化。
pre-miR-204经过剪切能形成miR-204-3p和miR-204-5p两个成熟体,一方面,miR-204-5p通过经典途径在胞浆靶向SR-A 3’-UTR抑制SR-A的表达。另一方面,通过ChIP-seq/ChIP-PCR/RIP等技术发现miR-204-3p在细胞核通过抑制Ago2蛋白和组蛋白H3K27ac、H3K4me3在CD36启动子上的富集从而参与CD36的转录调控。该研究还利用Crispr/cas9基因编辑技术突变NFATc3在miR-204启动子上的结合位点,再次证实miR-204介导了NFATc3对于SR-A和CD36的抑制作用。此外,在体动物实验证明巨噬细胞过表达miR-204-5p和miR-204-3p能明显抑制NFATc3敲除对动脉粥样硬化的促进作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


