新发现!SOAT1是p53缺陷型肝癌的潜在生物标志物和治疗靶点
来源:生物谷原创 2022-04-21 17:14
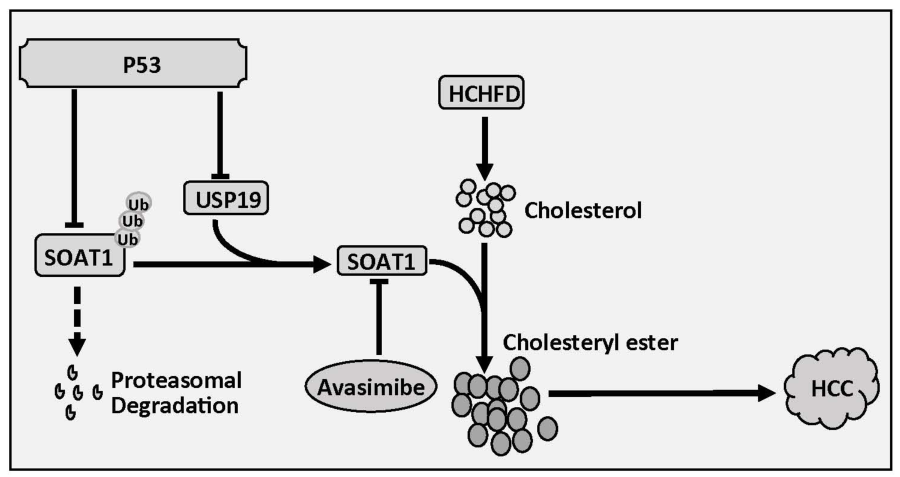
该研究表明,P53缺失和/或突变直接导致USP19和SOAT1表达增加,以促进胆固醇酯化,从而支持肿瘤的发生。
肿瘤抑制基因P53在癌症的发展中起着核心作用,超过60%的人类癌症携带P53基因错义突变或缺失。P53调控许多生物过程,包括应激反应和生长。P53还通过监测糖脂代谢来控制细胞代谢和能量动态平衡。后一种功能包括P53抑制胆固醇生物合成和抑制肿瘤生长的能力。
胆固醇是维持细胞生长、细胞膜完整性和流动性所必需的一种基本脂质。胆固醇是通过直接饮食吸收或乙酰辅酶A通过甲氧戊酸途径从头合成获得的。在许多癌症中,这一途径中的几种酶被解除调控,包括HMGCR和Sqle。因此,异常的胆固醇摄取和合成是癌症潜在的代谢脆弱性。
胆固醇酯的生物合成和动态平衡在包括肝细胞癌在内的许多癌症中起着关键作用,但它们在肝癌疾病发展中的确切作用机制尚不清楚。

图片来源: https://doi.org/10.1002/hep.32518
近日,武汉大学的研究者们在Hepatology杂志上发表了题为“P53 Deficiency Affects Cholesterol Esterification to Exacerbate Hepatocarcinogenesis”的文章,该研究结果表明,SOAT1通过促进胆固醇酯化参与了肝癌的发生,从而表明SOAT1是p53缺陷型肝癌的潜在生物标志物和治疗靶点。
在本研究中,研究者报告了一个新发现的肿瘤抑制因子P53在其抑制泛素特异性多肽酶19(USP19)和固醇O-酰基转移酶1(SOAT1)中的作用,后者维持胆固醇酯的稳态。USP19通过去泛素化和稳定SOAT1促进胆固醇酯化,促进肝癌的发生。
SOAT1或USP19的缺失显著降低了以正常饮食(NCD)或高胆固醇、高脂肪饮食(HCHFD)喂养的p53基因缺陷小鼠的胆固醇酯化和肝癌的发生。与从头合成胆固醇的抑制剂相比,SOAT1抑制剂avasimibe对HCHFD维持的p53缺陷小鼠的肝癌进展有更多的抑制作用。在人类肝癌中研究发现P53-USP19-SOAT1信号轴在人类肝癌中也存在失调。
P53-USP19-SOAT1信号轴在人肝癌中表达异常
图片来源: https://doi.org/10.1002/hep.32518
总之,该研究表明,P53缺失和/或突变直接导致USP19和SOAT1表达增加,以促进胆固醇酯化,从而支持肿瘤的发生。Avasimibe等药物对SOAT1的抑制代表了一种可行的新的治疗策略,特别是那些面对HCHFD而出现的、由p53缺失或突变驱动的肝癌。类似的治疗方法可能适用于其他癌症,因为Usp19和SOAT1上调的频率与较低的存活率相关。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


