宣称“打一针永久预防心脏病”,Verve公司首个碱基编辑临床试验申请被FDA暂停
来源:生物世界 2022-11-10 10:53
Beam 公司 CEO John Evans 表示,将在今年年底登记入组第一个参与镰状细胞病临床试验的患者。
碱基编辑治疗公司 Verve Therapeutics 发布声明,FDA已暂停了其主要候选药物 Verve -101 的临床试验研究新药申请。受此消息影响,Verve 公司股价大跌30%,目前总市值为13亿美元。
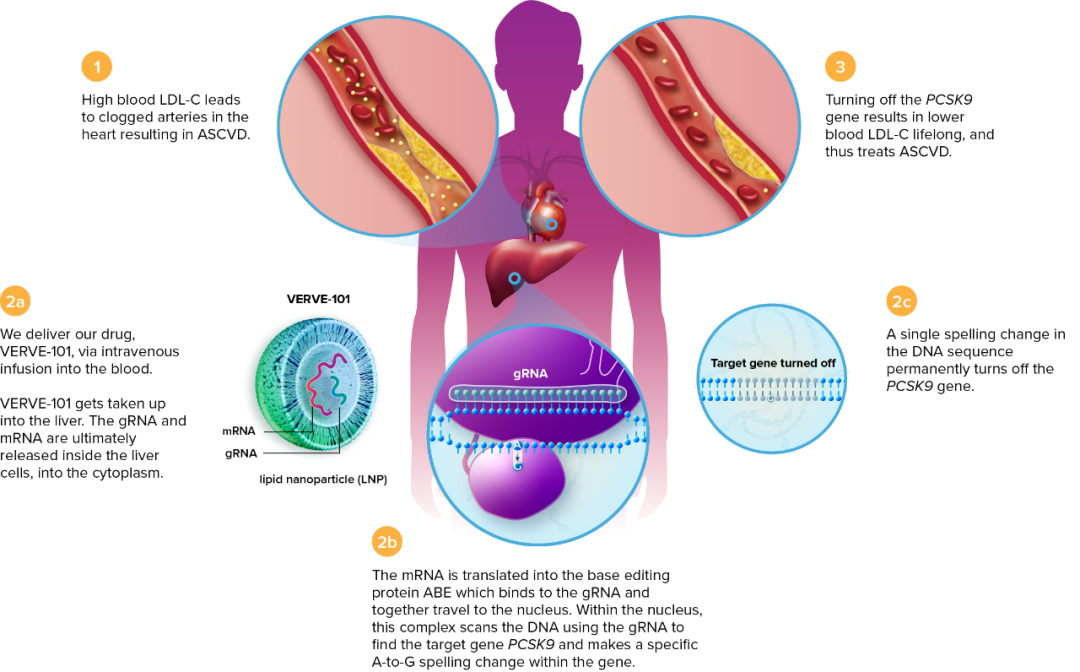
Verve -101 是首个进入临床的体内碱基编辑疗法,VERVE-101 疗法旨在通过脂质纳米颗粒(LNP)递送的碱基编辑器(Base Editor)永久关闭肝脏中 PCSK9 基因的表达,从而降低低密度脂蛋白胆固醇(LDL-C),以实现对包括杂合子家族性高胆固醇血症(HeFH)在内的心血管疾病的预防和治疗。
目前尚不清楚 FDA 暂停其 IND 申请的具体原因,预计 Verve 公司将在30天内受到 FDA 正式通知信函,其中包括 FDA 针对该申请提出的问题。
Verve 公司由著名心脏病专家 Sekar Kathiresan 等人创立,致力于通过碱基编辑技术开发心脏病预防针,实现一次注射,永久预防心脏病。
 Sekar Kathiresan
Sekar Kathiresan
2019年5月7日,Verve 作为初创公司拿到了 Google 等公司的5850万美元的 A 轮融资,这也是该公司首次亮相。2021年6月1日,Verve 在纳斯达克上市。从不足10人的初创团队到纳斯达克上市,Verve 仅仅用了两年时间。

Verve -101 疗法的原理
低密度脂蛋白(LDL),是一种富含胆固醇的脂蛋白,当其过量时,它携带的胆固醇便积存在动脉壁上,容易引起动脉硬化等心血管疾病。因此低密度脂蛋白(LDL)也被称为“坏胆固醇”。
Sekar Kathiresan 在研究冠状动脉疾病的相关基因时,发现了60多种可以降低血液中“坏胆固醇”水平的基因,这些基因可用于预防心血管疾病的发生。
这些能够降低“坏胆固醇”水平的基因中,研究的最深入的是 PCSK9 基因,PCSK9 基因表达的 PCSK9 蛋白能够与与肝细胞表面的 LDL 受体(LDL-R)结合,使 LDL-R 降解,从而升高血浆中低密度脂蛋白胆固醇水平。降低 PCSK9 基因的表达或抑制 PCSK9 蛋白与 LDL-R 的结合,就能降低血浆中低密度脂蛋白胆固醇水平,从而预防心血管疾病的发生。
现有的药物,都是在基因转录后(例如siRNA药物)或表达后(例如PCSK9的单抗)起作用,但 Sekar Kathiresan 认为,这些疗法或药物都是治标不治本,需要长期服用药物或注射,而通过碱基编辑,在 DNA 层面治疗,就能实现一次性注射,永久防止心血管疾病,既解除了长期用药带来的负担,还能节省治疗费用。
临床前研究数据
2022年10月31日,Verve 公司在 Circulation 期刊发表了题为:Efficacy and Safety of an Investigational Single-course CRISPR Base Editing Therapy Targeting PCSK9 in Non-human Primate and Mouse Models 的研究论文。

这项临床前研究在猴子中研究了 Verve -101 疗法编辑 PCSK9基因的安全性、有效性、持久性、耐受性以及是否会影响生殖细胞。
结果显示,接受0.75mg/kg剂量的猴子在治疗一年后,血液中的 PCSK9 蛋白平均减少67%,LDL-C 平均减少49%。在治疗后476天的评估中,接受1.5mg/kg剂量的猴子在治疗476天后,血液中 PCSK9 蛋白平均减少83%,LDL-C 平均减少69%。
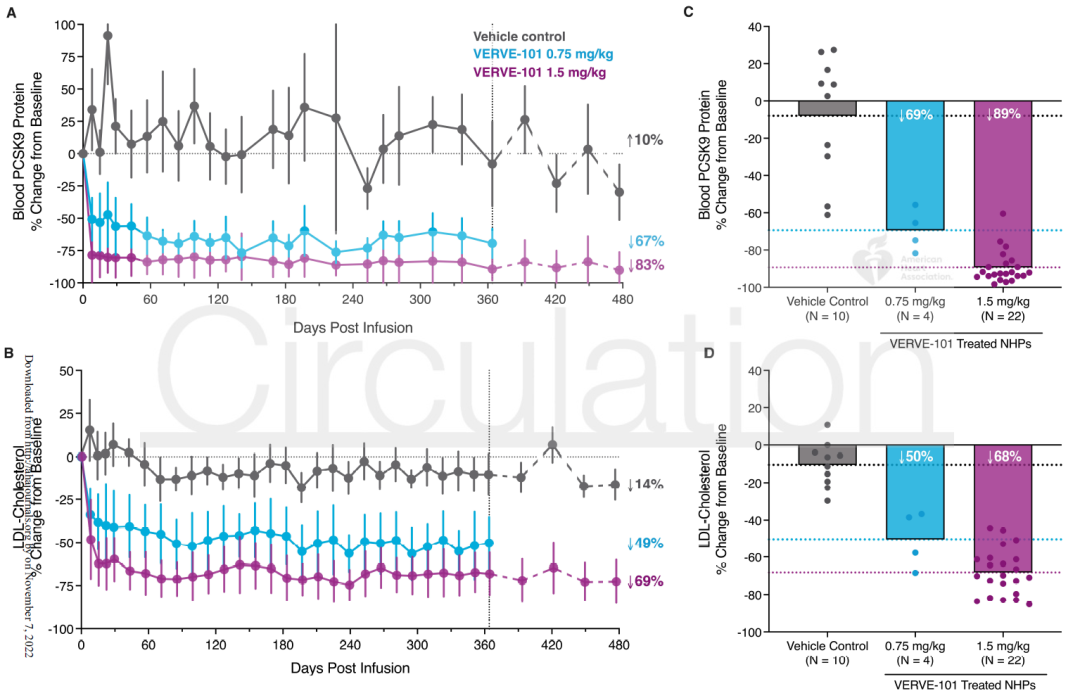
此外,该研究还显示,在碱基编辑治疗后的雄性猴子的精子中未发现对 PCSK9 的编辑,在碱基编辑治疗后的雌性小鼠的后代中也未发现对 PCSK9 的编辑。
Verve 的临床进展
2022年7月12日,Verve Therapeutics 宣布,其开发的碱基编辑疗法 VERVE-101 在新西兰完成了首例患者给药,该疗法用于治疗杂合子家族性高胆固醇血症(HeFH),这也是世界首个体内碱基编辑的临床试验。这标志着下一代基因编辑技术——碱基编辑开始进入临床试验,也标志着基因编辑技术开始进入常见疾病的治疗。
该试验旨在通过附加的药代动力学分析和血液PCSK9蛋白和LDL-C的减少来评估Verve -101的安全性和耐受性。
Verve 公司表示,目前已经接受治疗的3名患者耐受性良好,没有出现治疗相关的不良事件。该临床试验计划招募40名成年患者,目前正在新西兰和英国招募中。
对 Beam 的影响
Verve 公司使用的碱基编辑器来自碱基编辑公司 Beam Therapeutics 的授权。因此,FDA 暂停 Verve 公司的 IND 申请,也对 Beam 的股价产生了明显影响,Beam 股价现在下跌了11%,目前总市值26亿美元。

此外,在今年8月份,FDA 也暂停了 Beam 的基于碱基编辑的异基因 CAR-T 细胞疗法 BEAM-201。
FDA要求Beam公司进一步提供:
1、来自基因组重排评估的额外对照数据;
2、对某些脱靶编辑实验的进一步分析
3、细胞因子非依赖性生长试验的额外对照数据;
4、更新的研究者手册,其中包括有关任何新的非临床研究的信息。
从上述要求来看,FDA 对 BEAM-201 疗法的担忧是多么方面的,其中包括了对 Beam 公司的碱基编辑技术本身的潜在风险和脱靶性的担忧。除了要解决FDA提出的问题外,Beam 公司还在报告中表示,需要进行比预期更多的基因编辑才能实现异基因 CAR-T 细胞疗法。这也意味着 Beam 公司今年将不再推进其另一款 CAR-T 疗法进入临床。
虽然基于碱基编辑的 CAR-T 细胞疗法受挫,但 Beam 公司仍将继续推动两款治疗罕见遗传病的碱基编辑疗法进入临床试验,分别是BEAM-101(治疗镰状细胞病和β-地中海贫血)和BEAM-102(治疗镰状细胞病)。
Beam 公司 CEO John Evans 表示,将在今年年底登记入组第一个参与镰状细胞病临床试验的患者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


