Cancer Res: 靶向Plk1使胰腺癌对免疫检查点治疗增敏
来源:生物谷原创 2022-08-25 17:37
胰腺导管腺癌是所有癌症中死亡率最高的。PDAC的形成始于腺泡至导管的化生(ADM),这是急性胰腺炎的标志,其次是胰腺上皮内瘤变(Panin),大多数PDAC的前驱病变。
胰腺导管腺癌是所有癌症中死亡率最高的。PDAC的形成始于腺泡至导管的化生(ADM),这是急性胰腺炎的标志,其次是胰腺上皮内瘤变(Panin),大多数PDAC的前驱病变。相反,只有少数PDAC起源于囊性肿瘤,如导管内乳头状黏液性肿瘤(IPMN)。除了对符合条件的患者进行手术外,护理治疗的标准是吉西他滨;然而,这种治疗策略显示出有限的成功。

图片来源: https://doi.org/10.1158/0008-5472.CAN-22-0018
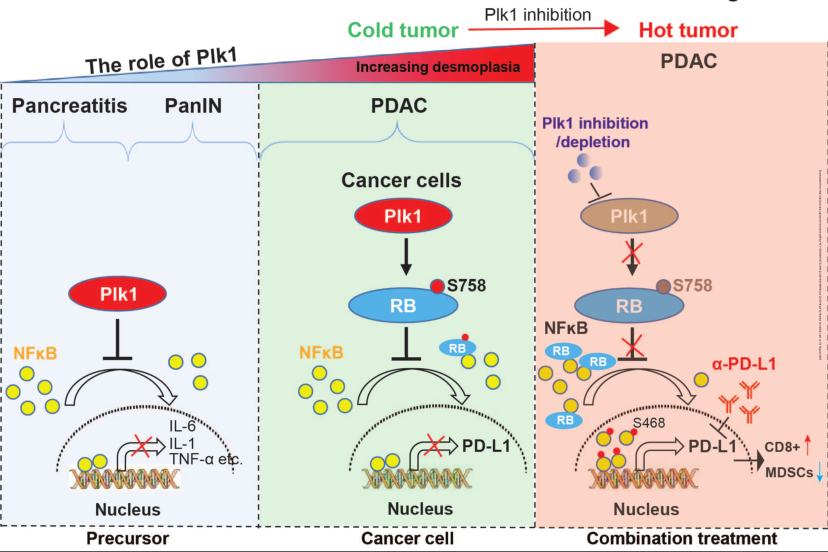
近日,来自肯塔基大学的研究者们在cancer research杂志上发表了题为“Targeting Plk1 sensitizes pancreatic cancer to immune checkpoint therapy”的文章,该研究证实了Plk1抑制了pDAC的进展并抑制了NF-κB的活性,靶向plk1可以增强pDAC的免疫治疗效果。
Polo-like kinase1(Plk1)在细胞周期调控中发挥重要作用。最近的工作表明,Plk1可能是胰腺导管腺癌(PDAC)吉西他滨反应的生物标志物。虽然靶向Plk1治疗PDAC已在临床试验中尝试,但结果并不令人乐观,而且对Plk1抑制的耐药机制尚不清楚。此外,Plk1在PDAC进展中的作用还需要进一步阐明。
在本研究中,研究者发现Plk1与PDAC患者的不良预后相关。在胰腺特异表达Plk1的可诱导转基因小鼠中,Plk1过表达显著抑制了雨蛙素诱导的急性胰腺炎以及腺泡-导管化生(ADM)和胰腺上皮内瘤变(Panin)的延迟发展。
生物信息学分析确定了Plk1参与PDAC疾病进展的调控网络,包括多条与炎症相关的途径。出乎意料的是,Plk1的抑制或耗尽导致了PD-L1的上调,这是通过激活NFκB途径实现的。在机制上,Plk1介导的Rb在S758的磷酸化抑制了核转录因子κB的核转位,使该途径失活。通过激活抗肿瘤免疫反应抑制Plk1敏化的PDAC对免疫检查点阻断治疗的影响。
靶向Plk1使胰腺癌对免疫检查点治疗增敏
图片来源: https://doi.org/10.1158/0008-5472.CAN-22-0018
总之,本研究证实Plk1和PD-L1的水平与PDAC患者的预后相关,这可以通过T细胞浸润的差异来区分。研究结果表明,Plk1在胰腺癌的早期阶段具有肿瘤抑制作用,并且在PDAC中Plk1对PD-L1具有负调控作用,提示通过联合抑制Plk1来改善PDAC的免疫治疗具有新的可能性。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


