Nature重磅:ADC+碱基编辑,清除白血病细胞的同时,重建血液系统
来源:生物世界 2024-05-30 10:45
该研究将CD45靶向的ADC与基因工程造血干细胞(HSC)相结合,创建了一种几乎通用的替换造血系统的策略,无论疾病的病因或起源细胞类型如何。
瑞士巴塞尔大学的研究人员在 Nature 期刊发表了题为:Selective haematological cancer eradication with preserved haematopoiesis 的研究论文。

可以通过移植造血干细胞(HSC)来重建整个造血系统,现在,造血干细胞移植(HSCT)已成为一种成熟的临床疗法,但高效的抗原特异性细胞耗竭药物模式,例如ADC药物或CAR-T细胞疗法,有望靶向耗竭造血干细胞和肿瘤细胞,从而可能大大改善造血干细胞移植(HSCT)。然而,肿瘤细胞和其他健康细胞(例如造血干细胞、T细胞)共同表达的抗原导致潜在毒性风险。此外,造血细胞类型的多样性以及血液肿瘤细胞表达数百种不同细胞表面抗原的复杂性、异质性,使得靶点选择困难。
鉴于这些局限性,研究团队改变了靶点选择的标准——不强调抗原表达的细胞类型特异性,而是找一个广泛表达于所有造血细胞(包括造血干细胞和祖细胞、白血病干细胞和分化细胞),但不在非造血细胞表达的靶点。
CD45就是符合这一要求的靶点,其仅由造血起源的有核细胞表达,代表了一种泛造血标志物。此外,靶向小鼠CD45的抗体偶联药物(ADC)可有效耗竭长期重建的造血干细胞(LT-HSC),从而实现同种异体造血干细胞移植。
然而,由于CD45+细胞对造血、免疫防御和许多非免疫功能至关重要,如果没有额外的预防措施,高效的CD45靶向治疗是难以长期耐受的。在造血干细胞和祖细胞(HSPC)中敲除CD45会会导致重度联合免疫缺陷。而该团队之前的研究证实,在小鼠CD45中替换一个氨基酸可消除其与单克隆抗体的结合,但不影响其表达和功能。此后,还有研究对人类HSPC进行了工程改造,使其免受抗原特异性治疗的影响,但保留其功能,并维持了植入和多向分化潜能。
因此,该研究的目标是工程化改造CD45,使其对靶向CD45的ADC耐药,但保持造血干细胞的功能,从而使靶向治疗成为可能。
在这项研究中,研究团队开发了一种高效的靶向CD45的抗体偶联药物(ADC),并与碱基编辑技术结合,对用于移植的HSPC的CD45进行碱基编辑,从而使其在保留CD45的表达和功能的情况下,不受ADC药物的影响,保留其在输注到体内后的长期重建血液系统的潜力。
研究它在小鼠体内实验中证实,靶向泛造血标志物CD45的抗体偶联药物(ADC),可特异性地清除整个造血系统,包括造血干细胞(HSC)。然后,将这种ADC药物与经过碱基编辑的人造血干细胞移植相结合,可在选择性清除体内白血病细胞的同时保留移植的造血干细胞的造血功能。
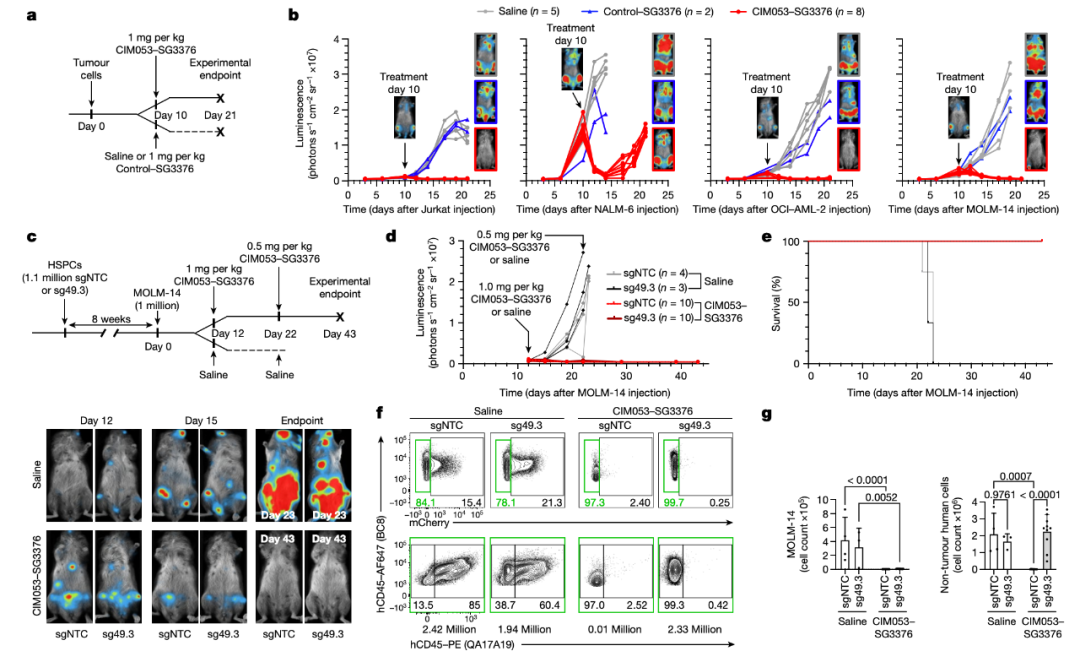
总的来说,该研究将CD45靶向的ADC与基因工程造血干细胞(HSC)相结合,创建了一种几乎通用的替换造血系统的策略,无论疾病的病因或起源细胞类型如何。这一方法不仅适用于血液系统恶性肿瘤,还可应用于更广泛血液系统疾病领域。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


