《细胞》子刊:科学家发现控制“癌王”转移的开关!
来源:奇点糕 2022-10-24 13:31
这项研究发现MSRA的缺失可促进胰腺癌的转移,而这种作用是依赖于对PKM2甲硫氨酸M239位点的氧化,且使用药理学激活剂激活PKM2可显著促进胰腺癌的转移。
胰腺癌被称为“癌中之王”。
胰腺癌的5年生存率不及10%[1],具有早期诊断困难、恶性程度高、生存率低等特点。其中,转移导致的疾病迅速进展,是胰腺癌生存预后差的重要原因。
我们都知道,活性氧(ROS)与肿瘤进展密切相关,有研究表明胰腺癌在进展中会出现高度复杂的氧化还原信号转导[2],然而不同的氧化还原机制是否与胰腺癌转移能力强有关还尚未可知。
在氧化还原反应中,蛋白质中的半胱氨酸残基起到“开关”的作用,先前的研究表明,半胱氨酸氧化可以抑制胰腺癌的发生[3],因此,这种基于蛋白质的氧化还原信号转导或许在胰腺癌的恶性功能中发挥着重要作用。
目前对蛋白质氧化还原信号转导的研究大部分集中于半胱氨酸之上,但对另一种含硫氨基酸-蛋氨酸的可逆性氧化关注较少。蛋氨酸与生物体内各种含硫化合物的代谢密切相关,目前已证明与一些生理过程中的氧化还原反应有关[4]。甲硫氨酸亚砜还原酶(MSRA)是一种蛋氨酸相关的氧化还原酶,同样与多种病理改变有明显的相关性[5]。然而,目前尚不清楚蛋氨酸残基是否也可以作为氧化还原反应的“开关”,并调控胰腺癌的进展。
近日,由哥伦比亚大学癌症遗传学研究所Iok In Christine Chio及Christopher J Chang领衔的研究团队,在Molecular Cell上发表了一项重要研究成果,揭示了蛋氨酸氧化与胰腺癌转移的关系。
他们发现蛋氨酸氧化抑制因子MSRA可抑制胰腺癌的转移,并揭示了MRSA缺失促进胰腺癌转移的关键分子机制[6]。总之,这项研究揭示了胰腺癌转移的新机制,并开发了可抑制胰腺癌转移的关键分子。

文章封面截图
为确认基于蛋氨酸的氧化还原信号是否会影响到胰腺癌的转移能力,研究人员探究了抑制蛋氨酸氧化的关键酶MSRA对胰腺癌转移的影响。
通过样本(临床样本及小鼠模型)验证、类器官及小鼠胰腺肿瘤细胞的基因编辑,以及胰腺癌肝转移模型,研究人员发现:在转移性的样本中,MSRA转录水平无明显差异,而其蛋白质稳定性明显降低。
他们还发现敲除MSRA的类器官、细胞及肝转移模型表现出更强的转移能力,因此,MSRA的缺失可显著促进胰腺癌的转移。
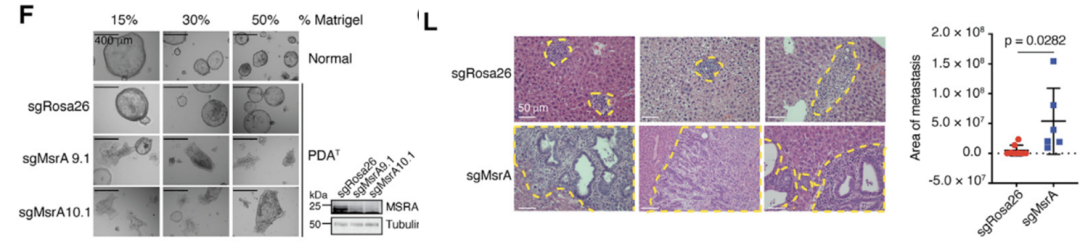
MSRA是胰腺癌转移的抑制因子
以上研究结果表明蛋氨酸氧化与胰腺癌转移具有明显的相关性,那这种蛋氨酸氧化是通过什么机制促进了胰腺癌的转移呢?
研究人员发现转移性胰腺癌类器官中线粒体氧化水平较高,但敲除MSRA后并没有发现线粒体氧化水平的改变,这表明MSRA的缺失并没有影响到原发性胰腺癌中的活性氧水平,也没有激活与转移相关的信号通路。因此,MSRA可能会通过影响蛋白质氧化态来控制胰腺癌转移。
为确定MSRA是否会通过调控蛋白质的氧化态促进胰腺癌的转移,研究人员对正常组织、原发性肿瘤,转移性肿瘤的类器官进行了蛋白质组学检测。
他们发现原发性胰腺癌及转移性胰腺癌类器官中的蛋氨酸氧化程度明显增加,且以转移性胰腺癌类器官中的改变为主。此外,在转移性类器官中,超过一半的蛋氨酸氧化蛋白参与了糖酵解代谢途径。

转移性类器官中蛋氨酸氧化蛋白组学
那么,这种蛋白质氧化修饰是如何调控胰腺癌葡萄糖代谢的呢?
研究人员发现MSRA的缺失并不会引起细胞外酸化率的改变,但是经13C同位素标记的丙酮酸含量显著增加,而糖酵解中间体并无变化。
因此,MSRA的缺失是促进了胰腺癌中葡萄糖的氧化磷酸化,并不是促进了经典的糖酵解途径。此外,转移性胰腺癌中表现出了MSRA依赖性的耗氧率和细胞迁移能力的增加。
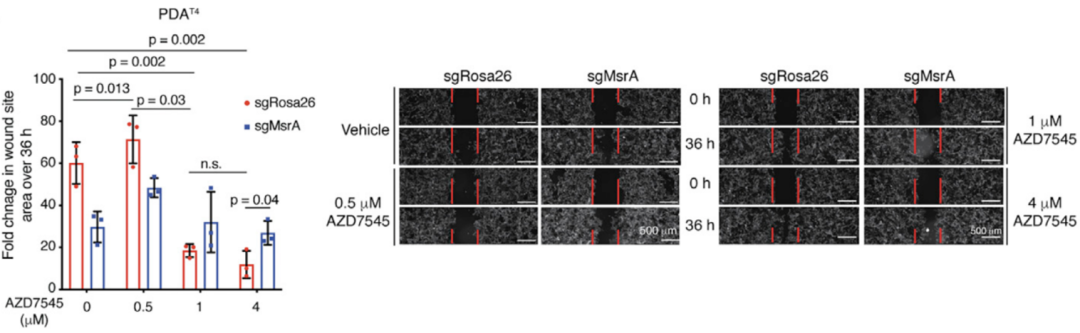
MSRA缺失促进胰腺癌中葡萄糖的氧化磷酸化
考虑到丙酮酸激酶M(PKM)是催化磷酸烯醇式丙酮酸和ADP转化为丙酮酸和ATP的关键酶,再结合MSRA缺失对丙酮酸转化的影响及反应性蛋氨酸的蛋白质组学,研究人员将PKM鉴定为MSRA介导的葡萄糖代谢的主要靶标。
此外,研究人员发现MSRA缺失不会引起PKM蛋白表达的改变,但增加了PKM的蛋氨酸氧化状态,并增加了丙酮酸激酶PKM的酶活性。
研究人员进一步探究了MSRA对PKM编码的两个产物PKM1和PKM2的影响,发现MSRA的缺失增加了PKM2的酶活性而非PKM1,且MSRA对PKM2的调控作用是由于MSRA是直接调节了PKM2的蛋氨酸氧化。
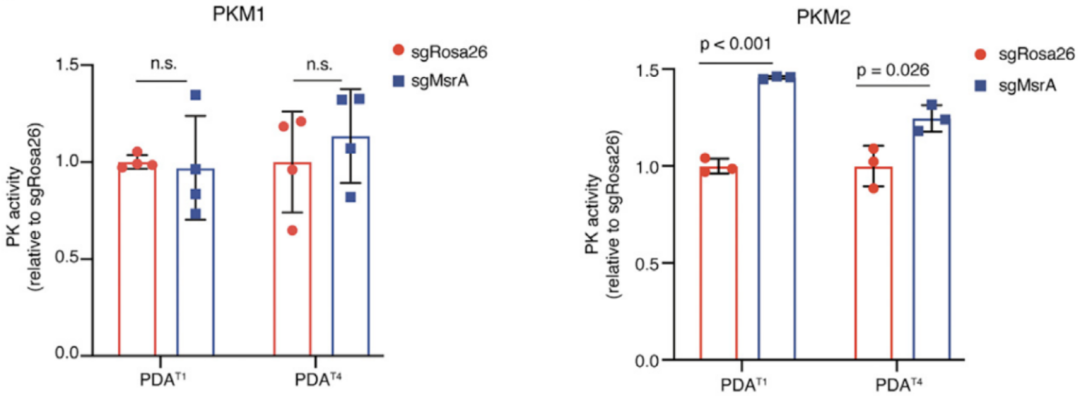
MSRA依赖PKM2蛋氨酸氧化促进丙酮酸激酶活性
为进一步明确MSRA调控PKM2蛋氨酸氧化的分子机制,研究人员分析了蛋白组学中PKM2上对氧化还原敏感的6个蛋氨酸残基,并发现只有甲硫氨酸M239的氧化还原状态在原发性和转移性胰腺癌类器官中发生明显改变。
此外,他们还发现MSRA介导的PKM2氧化促进了PKM2高活性四聚体的形成,而这种现象只有在野生型PKM2中观察到,在M239突变的PKM2中却未发现。因此,研究人员认为PKM2-M239的氧化状态以MSRA依赖性方式调节了PKM2的酶活性。
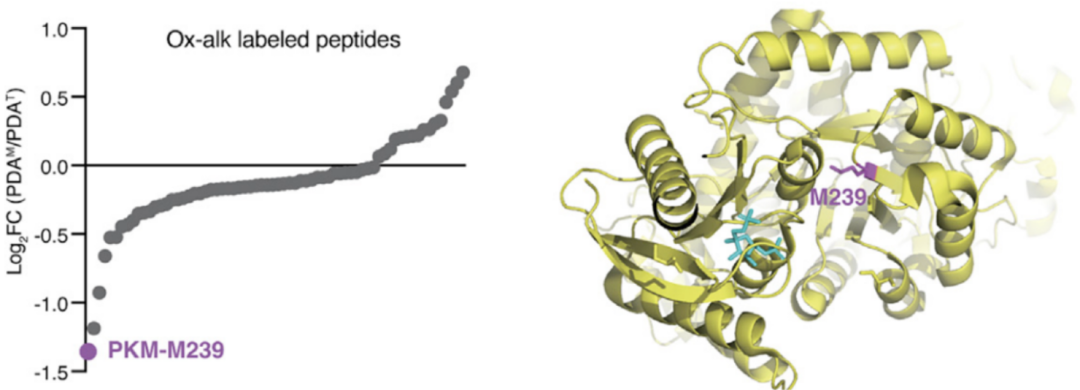
PKM在M239处的特异性氧化促进四聚体形成
基于以上数据,可以发现MSRA促进胰腺癌转移的能力是依赖于PKM2的,那在体内干预PKM2是否会引起胰腺癌转移能力的变化呢?
研究人员发现,使用PKM2的药理学激活剂TEPP46,可显著促进胰腺癌细胞的迁移能力,且TEPP46治疗显著提高了肿瘤的切除后复发率,以及胰腺癌小鼠模型的肝转移能力。

PKM的药理学激活会促进胰腺癌的转移
总之,这项研究发现MSRA的缺失可促进胰腺癌的转移,而这种作用是依赖于对PKM2甲硫氨酸M239位点的氧化,且使用药理学激活剂激活PKM2可显著促进胰腺癌的转移。
因此,这项研究证明了蛋氨酸氧化在胰腺癌转移中的重要作用,明确了其具体分子调控机制,并鉴定出影响胰腺癌转移的关键靶点MSRA及下游关键分子PKM2,为胰腺癌转移的靶向治疗提供了一种新的策略。
参考文献:
[1] Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014 Jun 1;74(11):2913-21. doi: 10.1158/0008-5472.CAN-14-0155.
[2] DeNicola GM, Karreth FA, Humpton TJ, et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis. Nature. 2011 Jul 6;475(7354):106-9. doi: 10.1038/nature10189.
[3] Chio IIC, Jafarnejad SM, Ponz-Sarvise M, et al. NRF2 Promotes Tumor Maintenance by Modulating mRNA Translation in Pancreatic Cancer. Cell. 2016 Aug 11;166(4):963-976. doi: 10.1016/j.cell.2016.06.056.
[4] Stadtman ER, Moskovitz J, Levine RL. Oxidation of methionine residues of proteins: biological consequences. Antioxid Redox Signal. 2003 Oct;5(5):577-82. doi: 10.1089/152308603770310239.
[5] Singh MP, Kim KY, Kim HY. Methionine sulfoxide reductase A deficiency exacerbates acute liver injury induced by acetaminophen. Biochem Biophys Res Commun. 2017 Feb 26;484(1):189-194. doi: 10.1016/j.bbrc.2017.01.025.
[6] He D, Feng H, Sundberg B, et al. Methionine oxidation activates pyruvate kinase M2 to promote pancreatic cancer metastasis. Mol Cell. 2022 Aug 18;82(16):3045-3060.e11. doi: 10.1016/j.molcel.2022.06.005.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


