Cell重磅:章冰/高强团队等利用泛癌蛋白基因组学分析,绘制癌症治疗靶点全景图
来源:生物世界 2024-06-26 10:08
临床蛋白质组肿瘤分析联盟(CPTAC)对1000多个前瞻性收集的、未经治疗的原发肿瘤进行了蛋白质组学和基因组学特征分析,涵盖了10种癌症类型,其中许多肿瘤还配有相应的正常组织样本。
贝勒医学院章冰团队、复旦大学高强团队及中国科学院分子细胞科学卓越创新中心高大明团队等在国际顶尖学术期刊 Cell 上发表了题为:Pan-cancer proteogenomics expands the landscape of therapeutic targets 的研究论文。
该研究通过整合10种癌症类型的1043名患者的蛋白基因组学数据、细胞系的基因依赖性数据以及肿瘤抗原预测,系统地识别并实验验证了新的癌症治疗靶点,绘制了用于药物再利用和新疗法开发的蛋白和肽段靶点的全景图。
此外,研究团队还在LinkedOmics工具系列 (https://www.linkedomics.org/ )下创建了一个新的网络门户(https://targets.linkedomics.org/),供研究人员访问该研究中发现的蛋白和肽段靶点及其支持数据。
论文通讯作者、章冰教授表示,很高兴我们创造了一个全面的蛋白质靶点资源,通过识别许多新的候选蛋白和覆盖各种治疗模式,显著地扩展了癌症治疗领域,希望这一资源将为现有药物的再利用和开发癌症新疗法铺平道路。

临床蛋白质组肿瘤分析联盟(CPTAC)对1000多个前瞻性收集的、未经治疗的原发肿瘤进行了蛋白质组学和基因组学特征分析,涵盖了10种癌症类型,其中许多肿瘤还配有相应的正常组织样本。CPTAC泛癌种资源工作组已对这10种癌症类型的所有组学数据进行了标准化,以用于泛癌种蛋白质组学研究。
在这项最新研究中,研究团队将上述数据集与其他公开数据集结合,以揭示癌症治疗的蛋白质靶点。该分析为现有的癌症药物靶点提供了新见解,并系统地识别出可作为药物再利用或开发的候选新靶点。这些候选蛋白包括过度表达和过度活跃的蛋白质依赖性、与肿瘤抑制基因(TSG)丢失相关的蛋白质依赖性、潜在的新抗原和肿瘤相关抗原。
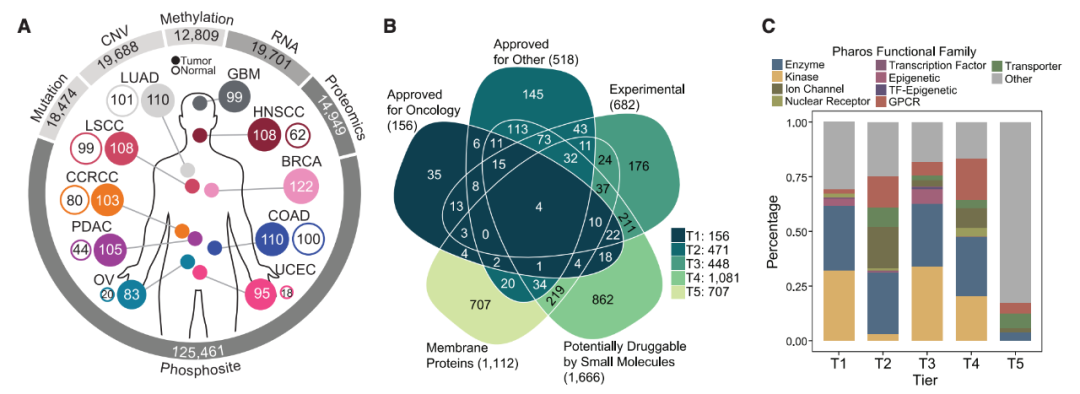
研究亮点:
1、靶向蛋白的系统分类和定量
研究团队系统收集了2863个潜在的小分子靶点蛋白和膜蛋白,并将其分类为五个等级,以便于患者选择、药物再利用和新疗法开发等不同应用。在CPTAC蛋白质组学数据中,超过80%的这些蛋白得到了量化。其中超过半数的蛋白在一种或多种癌症类型中显示出较差的mRNA-蛋白质相关性,揭示了用蛋白质组学量化药物靶点的必要性。
2、过表达和过度激活的蛋白
研究团队分析了各种癌症类型的蛋白质组数据,以识别在肿瘤组织中相对于正常组织显著过表达且在相同癌症谱系的细胞系中有显著依赖性的蛋白。在这些蛋白中,研究团队发现了457个潜在靶点蛋白,其中有51个在至少5种癌症类型中共享,是药物再利用和新疗法开发的最佳候选者。除了蛋白丰度之外,他们的分析还结合了磷酸蛋白组数据推断的蛋白活性,揭示了通过蛋白丰度无法识别的其他药物靶点。研究团队进一步利用公共数据和新的体外和体内实验验证了这些靶点的有效性。
3、合成致死策略
针对难以靶向的肿瘤抑制基因丢失,研究团队整合了CPTAC蛋白丰度、磷酸化位点和激酶活性数据以及DepMap基因依赖性数据,寻找与肿瘤抑制基因丧失相关的蛋白过表达,过度激活,以及升高的基因依赖性作为潜在靶点。这些靶点的抑制可能与肿瘤抑制基因的丢失形成合成致死关系。以TP53为例,研究团队发现TP53丢失突变可作为选择乳腺癌患者进行CHEK1抑制以及选择子宫内膜癌患者使用阿霉素治疗的候选生物标志物。阿霉素是一种用于子宫内膜癌的二线治疗药物,在未筛选患者中的总体反应率仅为16%。使用TP53丢失突变作为标志物筛选患者有可能大幅度提高反应率。
4、免疫疗法靶点的优先排序
研究团队还开发了计算流程来筛选新抗原和肿瘤相关抗原作为免疫治疗的靶点。大多数预测的新抗原只存在于单个患者,但五个KRAS突变肽被预测在来自四种癌症类型的44名患者中产生新抗原,具有作为“公共”新抗原的潜在用途。研究人员还找到了140种在正常组织中表达高度局限但在CPTAC肿瘤中异常表达的蛋白。他们对七个蛋白预测了与最常见的HLA-A02等位型具有高结合亲和力的肽段并在美国和中国人群进行了实验分析。实验结果鉴定出21个来自五种蛋白的肽段,这些肽段既具有强HLA结合亲和力又具有免疫原性,可进一步作为免疫治疗靶点进行研究。
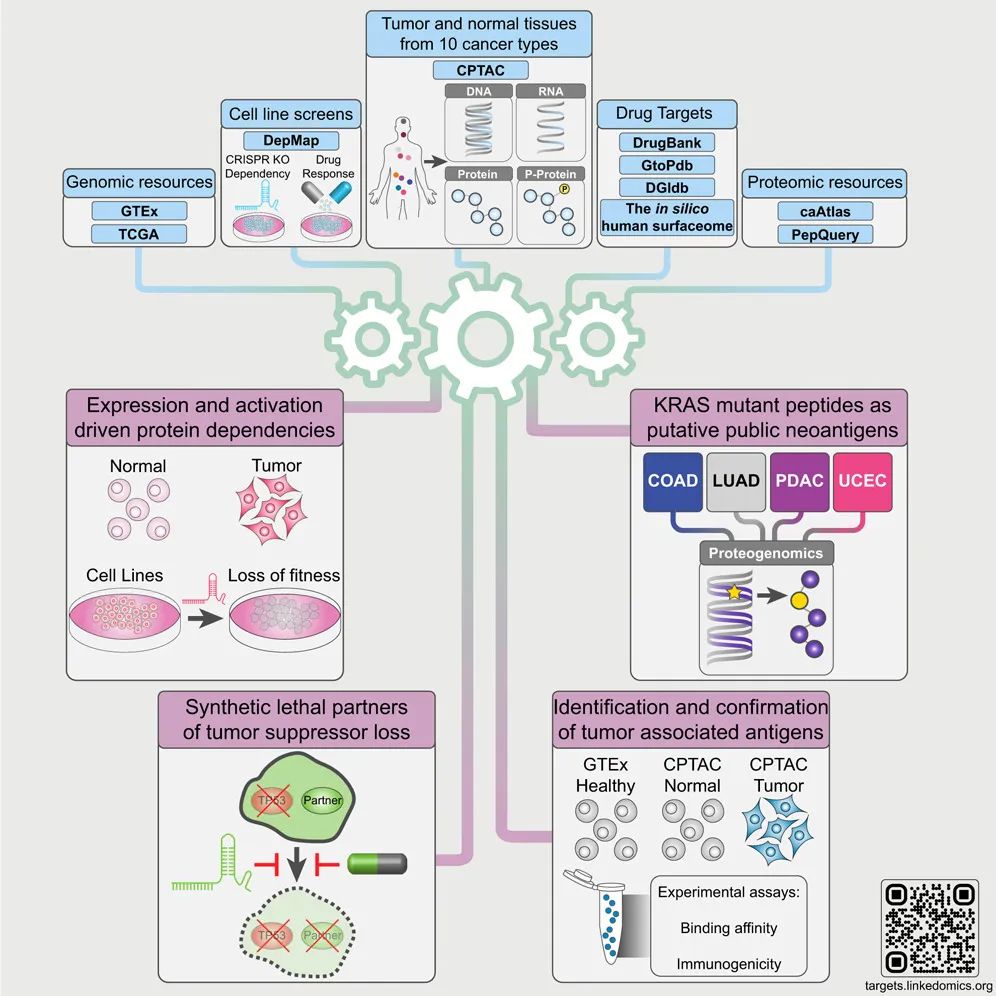
论文通讯作者、章冰教授表示,经验表明,靶向治疗,针对癌细胞中特定蛋白质,有望比传统的放疗和化疗获得更有效的临床结果。虽然在确定特定癌症类型的潜在脆弱性方面取得了进展,但FDA批准的癌症药物的靶向蛋白质不到200种。这项新研究通过分析10种癌症类型的1000多个组织样本的数据,显著扩展了潜在的治疗靶点列表。这项研究还揭示了将已获批用于其他疾病治疗的药物重新利用的新机会,例如,该研究证明了一种抗真菌药物也可以减少几种癌症类型的肿瘤生长,支持进一步探索这种药物的抗癌价值。
综上所述,该研究为癌症治疗创建了一个蛋白和肽段靶点的全景图,为未来的伴随诊断、药物再利用和新疗法的开发铺平了道路。这一开创性的研究结果展示了蛋白质组学在癌症治疗靶点识别中的巨大潜力,并为个性化医疗带来了新希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


