“网红”饮食法再登顶刊!Nature首度揭露:「间歇性禁食」竟可促进神经再生和修复
来源:生物谷 2022-07-21 16:20
临床上,周围神经系统(PNS)损伤发生率一直居高不下,而且仅有少数PNS损伤有机会通过外科手术重建得到良好治疗,其余绝大数只能让其“自生自灭,听天由命”。
临床上,周围神经系统(PNS)损伤发生率一直居高不下,而且仅有少数PNS损伤有机会通过外科手术重建得到良好治疗,其余绝大数只能让其“自生自灭,听天由命”。虽说PNS具备一定的自我修复和再生潜能,但因轴突再生效率低下、速度迂缓,导致PNS再生障碍重重[1]。难以得到有效的治疗最终会使患者感觉、运动和自主神经功能部分甚至完全丧失,带来无法逆转的沉重伤害和巨大的疾病负担[2]。
PNS若想实现“我命由我不由天”,加速轴突再生无疑就是重中之重。已有诸多研究表明间歇性禁食(IF)可以激活轴突再生的信号通路[3-4]、提高突触可塑性[5]、促进神经生长[6],但目前对于IF是否具备提升神经再生能力(特别是轴突再生能力)尚不明确。因此,亟需阐明IF与PNS轴突再生的相关性。
近日,伦敦帝国理工学院(IC)Simone Di Giovanni教授团队在顶级期刊Nature上发表了关于IF促进周围神经再生机制的重磅研究结果[7]。他们探究发现:IF可增加肠道微生物的代谢物吲哚-3-丙酸(IPA),并利用免疫介导机制促进周围神经轴突的再生和功能修复。为临床改善PNS损伤患者的神经功能预后开启了一个新思路。

论文首页截图
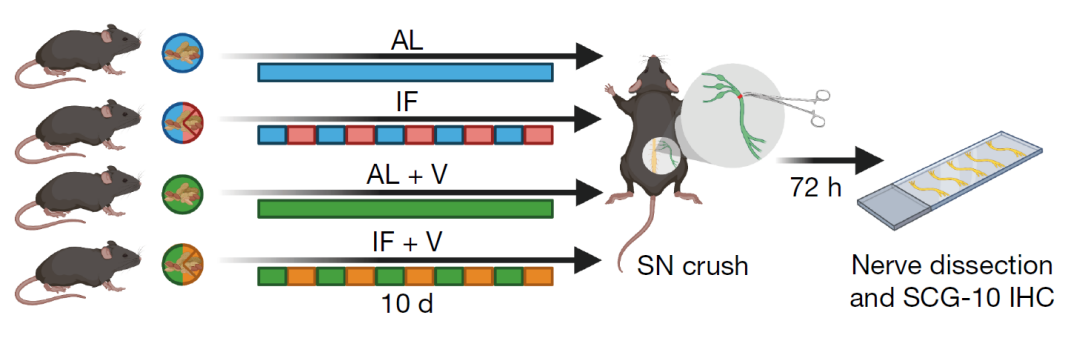
具体而言,研究团队分别对C57BL/6雄性小鼠(6-8周龄)进行10天的IF喂养(当天随意进食,隔天禁食)和常规喂养(AL,不受限制自由禁食),然后进行坐骨神经挤压损伤造模(SNC,手术切断从脊柱延伸到腿部的最长神经元),并在造模24/72小时后分别评估轴突再生和神经元恢复情况。
结果显示:在SNC造模72小时后,与AL喂养组相比,IF喂养组的坐骨神经轴突再生速度显著更快(P<0.01),脊髓背根节(DRG)神经元轴突生长增加了约50%(P<0.05)。
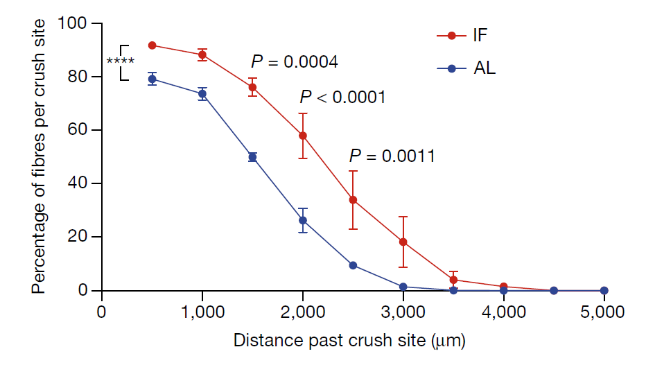
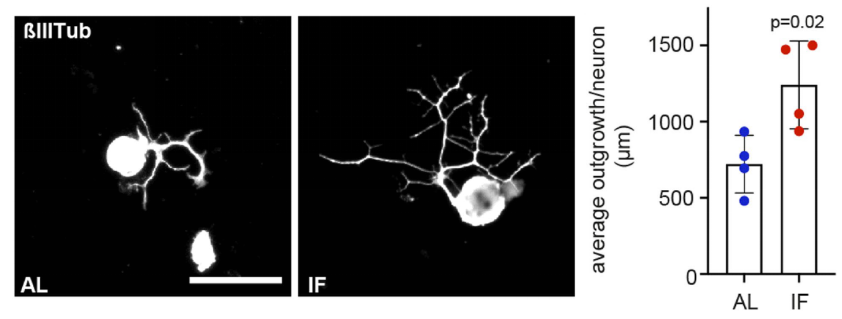
SNC造模72小时后,IF(红色)和AL(蓝色)喂养组DRG神经元轴突生长情况
而且IF并未改变轴突再生的关键细胞(如施万细胞和巨噬细胞)在坐骨神经挤压部位的聚集状况,也没有显著改变DRG中的神经营养因子(BDNF、NGF、NT-3和NT4/5)浓度。由此可以推测:施万细胞、巨噬细胞和神经营养因子并未在IF促进轴突再生的过程中发挥关键作用。那么到底是何方神圣在背后推波助澜呢?
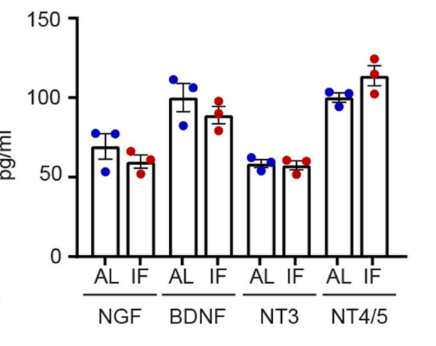
SNC造模72小时后,DRG四种神经营养因子浓度变化情况(无显著性变化)
研究团队做了一个大胆的推测:IF喂养方式改变了小鼠的饮食与代谢状态继而触发/促进轴突再生。随后对IF和AL喂养的小鼠血清进行代谢物检测(共检测79种代谢物),两组之间有多达14种代谢物(微生物衍生代谢物和宿主代谢物)存在显著性差异。
IF喂养组浓度升高最为显著的均为微生物衍生代谢物(3-吲哚乳酸,2,3-丁二醇,吲哚-3-丙酸(IPA)和木糖),巧合的是,这4种代谢物均与宿主代谢物无关。脉络开始逐渐清晰起来:IF喂养可能使肠道微生物及其代谢物发生变化,也许对轴突再生起到至关重要的作用。
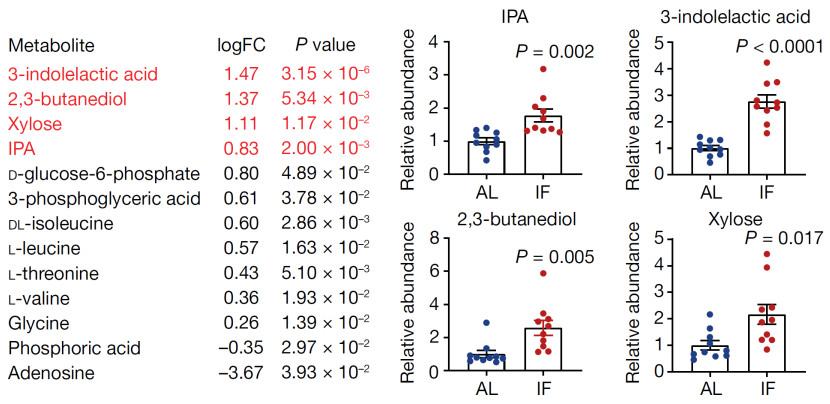
与AL喂养组相比,IF喂养组浓度升高最为显著的4种代谢物(红色字体)
为了进一步探索IF喂养导致肠道微生物变化在促进坐骨神经再生中的确切作用,IF喂养小鼠的肠道菌群被“移花接木”到AL喂养小鼠体内。没想到“乾坤大挪移”这种奇事居然在AL喂养的小鼠体内毫无违和地发生了,经过菌群移植后的AL喂养小鼠在SNC造模后神经再生的速度也明显加快。与此同时,若使用万古霉素显著降低革兰氏阳性菌(双歧杆菌、乳杆菌和生孢梭菌等能产生吲哚代谢物)的丰度,减少小鼠肠道菌群的多样性,IF促进轴突再生的能力近乎被削弱殆尽。双向结果均提示革兰氏阳性菌可能是IF促进轴突再生的关键所在,排除掉非吲哚类代谢物之后,离最终的答案已经越来越近了。
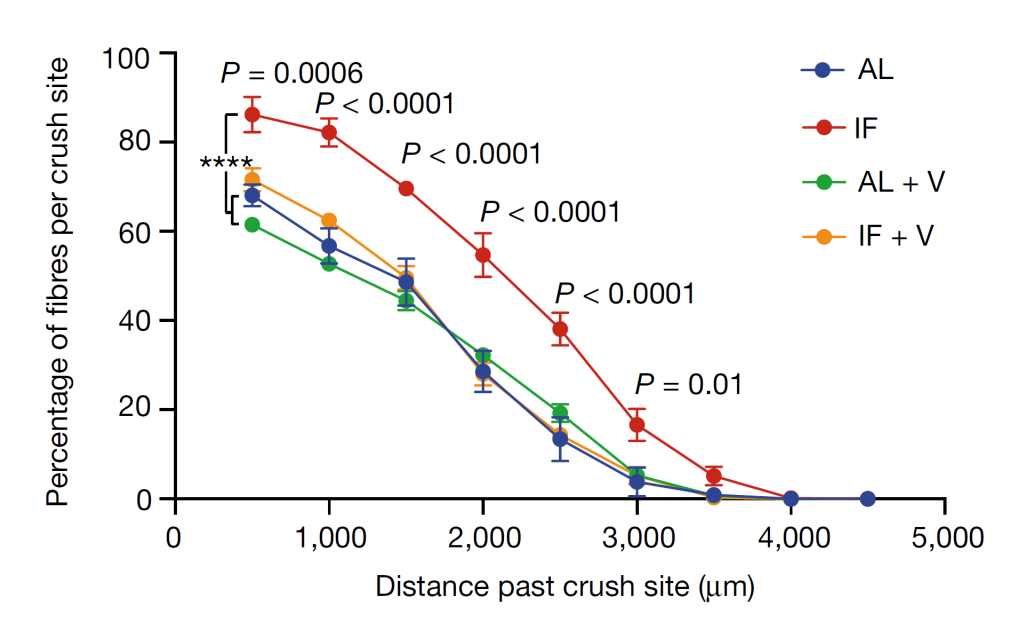
革兰氏阳性菌和万古霉素在IF促进轴突再生中的作用
那么究竟是哪一种/一些革兰氏阳性菌代谢物对轴突再生有促进作用呢?在分析IF或AL喂养小鼠是否进行万古霉素干预的血清代谢物变化后,发现能够被万古霉素显著影响的代谢物只有IPA。IPA真的就是背后的操盘手吗?
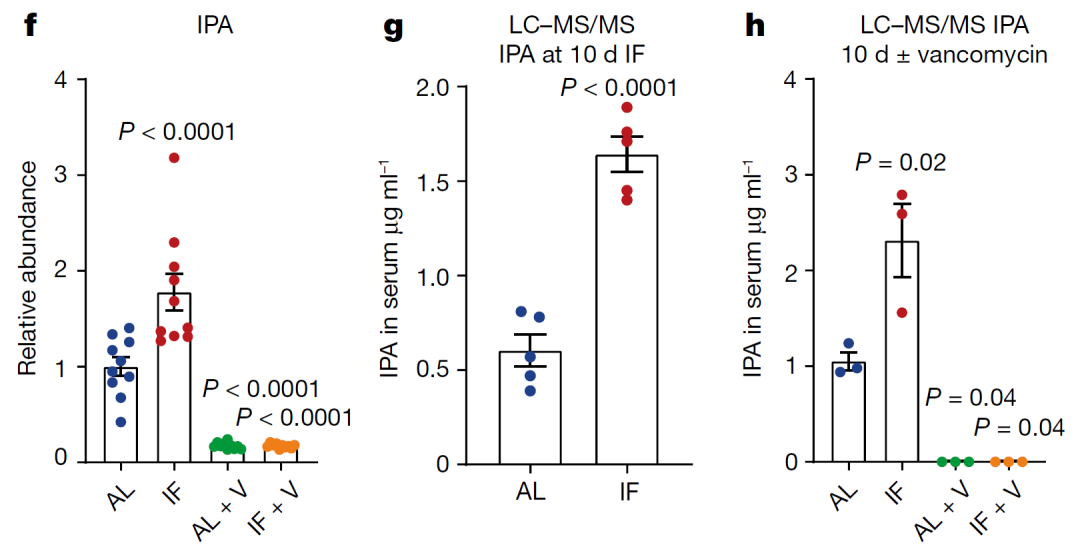
在万古霉素干预后IPA的血清浓度变化
科学容不得半点马虎,为了验证上述发现,对小鼠进行万古霉素干预之后,分别移植fldC突变生孢梭菌(这样的孢梭菌并不能产生IPA)以及野生型生孢梭菌(能够正常产生IPA),在SNC造模72小时后监测神经再生情况。不出所料,移植fldC突变生孢梭菌的小鼠轴突再生能力显著劣于移植野生型生孢梭菌的小鼠(P<0.05)。
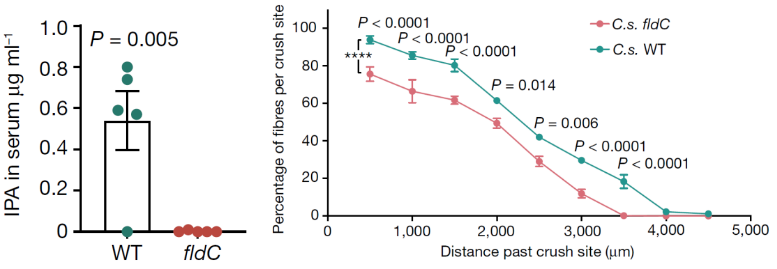
左图为移植fldc突变(红色)和野生型(绿色)孢梭菌后IPA血清浓度
右图为移植fldc突变(红色)和野生型(绿色)孢梭菌后轴突再生情况
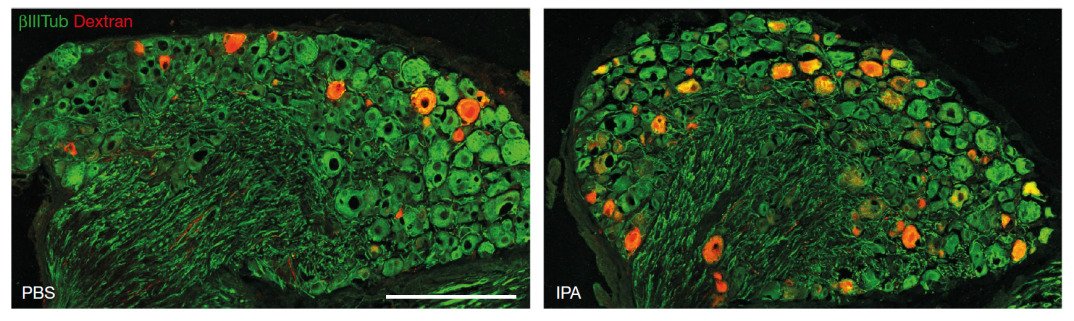
看到这些美丽的绿色荧光,那都是欣欣向荣的新生轴突啊,IPA组(右图)显著优于对照组(左图)
既然已经挖掘到IPA,那么溯本求源,厘清IPA促进轴突再生的潜在机制就如同箭在弦上不得不发了。通过对小鼠DRG神经元进行RNA测序得到初步答案:IPA高度选择性上调Cd177(中性粒细胞配体)和Cxcl1(内皮中性粒细胞趋化因子配体1)的基因表达,提示IPA可能通过CXCR2介导机制来激活中性粒细胞趋化通路和参与免疫调节。而且DRG组织内中性粒细胞数会在喂食IPA后增加,再次证明了以上结果。
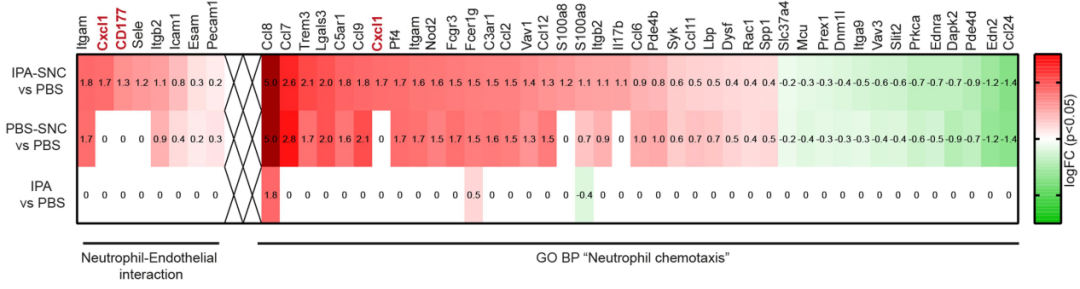
SNC造模72小时后,IPA所参与信号通路基因表达情况
无独有偶的是人类肠道中也广泛存在能产生 IPA 的生孢梭菌,并且在人类血液中也同样含有IPA。这项研究很有可能对人类也同样适用,毕竟小鼠试验的一小步,有可能成为人类医学发展的一大步。而且研究团队将继续优化IPA使用方案,以期达到最佳功效,为最终系统研究细菌代谢物治疗奠定基础。
总的来说,研究首次揭示了IF促进神经再生的潜在机制:IF可增加肠道革兰氏阳性梭菌产生的代谢物IPA,并在脊髓背根节中增加中性粒细胞的趋化,从而促进轴突再生。回顾以上研究思路,好比侦探破案一般,研究团队不断抽丝剥茧,在乍隐乍现中一步步揭露了肠道菌群如何干预轴突再生的机制。
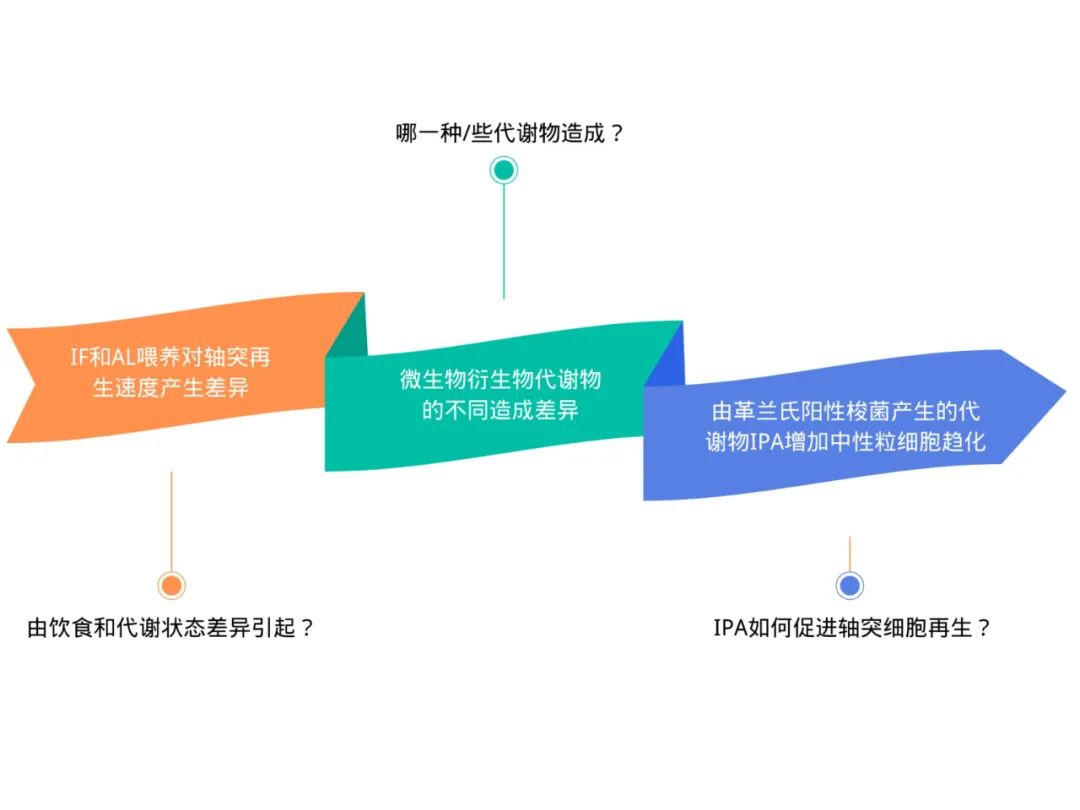
研究团队逐个击破,破解潜在机制
这项重磅研究同时也开辟了一个全新研究领域:是否还有其他代谢产物发挥类似作用?人类进行IF后 IPA 是否也会同样增加?IPA在人体中能否也能促进神经修复和轴突再生?反复多次口服 IPA能否最优化发挥治疗效果?……这些未知问题都值得去解答,一旦在人体中得到证实,将会使PNS损伤治疗之路步入新征程,踏上新台阶,就能及早造福患者。
参考资料:
1.Scheib J, Höke A. Advances in peripheral nerve regeneration. Nat Rev Neurol. 2013;9(12):668-676. doi:10.1038/nrneurol.2013.227.
2.Li R, Liu Z, Pan Y, Chen L, Zhang Z, Lu L. Peripheral nerve injuries treatment: a systematic review. Cell Biochem Biophys. 2014;68(3):449-454. doi:10.1007/s12013-013-9742-1.
3.Mattson MP, Moehl K, Ghena N, Schmaedick M, Cheng A. Intermittent metabolic switching, neuroplasticity and brain health [published correction appears in Nat Rev Neurosci. 2020 Aug;21(8):445]. Nat Rev Neurosci. 2018;19(2):63-80. doi:10.1038/nrn.2017.156.
4.Longo VD, Mattson MP. Fasting: molecular mechanisms and clinical applications. Cell Metab. 2014;19(2):181-192. doi:10.1016/j.cmet.2013.12.008.
5.Dasgupta A, Kim J, Manakkadan A, Arumugam TV, Sajikumar S. Intermittent fasting promotes prolonged associative interactions during synaptic tagging/capture by altering the metaplastic properties of the CA1 hippocampal neurons. Neurobiol Learn Mem. 2018;154:70-77. doi:10.1016/j.nlm.2017.12.004.
6.Lee J, Seroogy KB, Mattson MP. Dietary restriction enhances neurotrophin expression and neurogenesis in the hippocampus of adult mice. J Neurochem. 2002;80(3):539-547. doi:10.1046/j.0022-3042.2001.00747.x.
7.Serger E, Luengo-Gutierrez L, Chadwick JS, et al. The gut metabolite indole-3 propionate promotes nerve regeneration and repair [published online ahead of print, 2022 Jun 22]. Nature. 2022;10.1038/s41586-022-04884-x. doi:10.1038/s41586-022-04884-x.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


