研究发现可用于肿瘤免疫治疗的新型RORγt激动剂候选药物
来源:网络 2023-12-04 16:45
近年来,视黄酸受体相关孤儿受体RORγt的肿瘤免疫学调节功能受到广泛关注,RORγt也成为极具潜力的肿瘤免疫治疗新兴靶标。
近年来,视黄酸受体相关孤儿受体RORγt的肿瘤免疫学调节功能受到广泛关注,RORγt也成为极具潜力的肿瘤免疫治疗新兴靶标。研究表明,肿瘤微环境中高表达的辅助性T细胞17(Th17细胞)和其分泌的细胞因子白介素17(IL-17),能通过激活肿瘤特异性CD8+ T细胞(Tc17细胞)来抑制肿瘤增殖。RORγt在Th17和Tc17细胞中特异性表达,是调节CD4+ T细胞向Th17细胞分化、细胞毒性Tc17细胞产生及促炎因子IL-17A分泌的关键转录因子。RORγt激动剂能够促进Th17细胞分化及IL-17A的产生,激活Tc17细胞的杀伤力,从而发挥免疫抗肿瘤作用。因此,开发新型RORγt激动剂对于小分子肿瘤免疫治疗具有重要意义。
复旦大学药学院王永辉教授研究团队致力于新型RORγt小分子调节剂的发现及其作用机制研究,报道了多种不同骨架类型的RORγt调节剂,包括用于自身免疫性疾病治疗的RORγt抑制剂(反向激动剂)和用于癌症免疫治疗的RORγt激动剂;并在RORγt受体抑制-激动功能反转的分子机制方面深入探索,先后于2018年和2021年分别在药物化学领域权威期刊《药物化学杂志》(Journal of Medicinal Chemistry)上发表两篇综述(Miniperspective, J. Med. Chem. 2018, 61, 5794−5804; Perspective, J. Med. Chem.2021, 64, 10519–10536)。
近日,谢琼副教授和王永辉教授团队在药物化学权威期刊《药物化学杂志》(Journal of Medicinal Chemistry)上发表一篇新的研究性论文《高效、选择性和口服有效的联芳基酰胺类RORγt激动剂的发现及其癌症免疫治疗应用》(Discovery of Biaryl Amide Derivatives as Potent, Selective, and Orally Bioavailable RORγt Agonists for Cancer Immunotherapy)。该论文发现了一类具有成药潜力的联芳基酰胺类RORγt小分子激动剂,其不仅在体外表现出优异的RORγt受体激动活性及亚型选择性,而且在体内表现出良好的药代动力学性质,在小鼠黑色素瘤和小鼠肺腺癌两类模型中展现出良好的单药体内抗肿瘤效果,具有潜在的开发和应用前景。
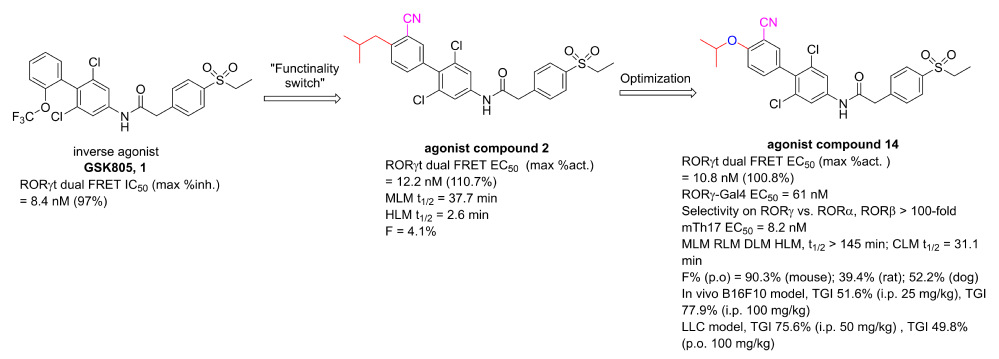
图1. 新型联芳基酰胺类RORγt激动剂的发现和成药性优化
本研究以RORγt反向激动剂GSK805(1)为起点,利用“功能翻转”策略在左侧苯环引入不同大小的对位取代基,得到异丁基取代的RORγt激动剂2。该化合物体外活性优异(EC50 = 12.2 nM),但肝微粒体稳定性(HLM: t1/2 = 2.6 min)和口服生物利用度(mice,F = 4.1%)较差。采用生物电子等排等策略对联芳基酰胺类化合物的左侧片段、连接链和右侧片段进行微调,以求在维持激动功能的前提下优化成药性,发现了优于临床II期化合物LYC-55716的潜在RORγt激动剂候选化合物14(图1)。异丙氧基取代的化合物14具有较强的RORγt激动效力(RORγt dual FRET: EC50 = 10.8 nM; mTh17: EC50 = 8.2 nM),较高的RORγ受体亚型选择性(>100倍),优异的多种属肝微粒体代谢稳定性(mouse, dog, rat and human LM: t1/2 > 145 min),以及优良的口服生物利用度(F = 90.3 % (mouse), 39.4% (rat), 52.2% (dog))。
体内药效评价和作用机制研究与复旦大学朱棣教授团队合作,化合物14表现出优异的体内抗肿瘤活性(图2),在小鼠B16F10黑色素瘤和LLC肺腺癌肿瘤模型中肿瘤生长抑制率(TGI)分别达到77.9%(100 mg/kg, i.p., 图2A)和75.6%(50 mg/kg, i.p., 图2B),且显著增加化合物14治疗组(25 mg/kg, i.p.)LLC肿瘤内CD3+ T细胞和CD4+ T细胞中IL-17A+细胞的比例(图2C-D),以及Rorc和Il-17a基因的表达水平(图2E-F)。化合物14的心脏hERG毒性低,mini-AMES试验显示无致突变作用,显示出作为新型RORγt激动剂候选药物在癌症免疫治疗方面的巨大潜力。

图2. 候选化合物14在小鼠B16F10(A)和LLC(B)肿瘤模型中的体内药效,以及化合物14治疗后LLC瘤内CD3+ T细胞(C)和CD4+ T细胞(D)中IL-17A+细胞比例及Rorc(E)和Il-17a(F)基因表达水平的变化
分子对接研究发现,化合物14的砜基与RORγt配体结合域(LBD)中的Leu287和Arg367形成关键的氢键作用,酰胺linker中的NH与Phe377的羰基形成氢键,结构中的三个苯环分别与Phe377、Phe378和Phe388形成π-π堆积作用(图3A)。为理解激动剂化合物14的异丙氧基如何通过稳定RORγt 活性功能域2(AF2)而将功能翻转为激动作用,该团队与复旦大学药学院李嫣副研究员团队合作完成动力学模拟研究。研究结果显示,苯环对位无取代的反向激动剂2b因与蛋白之间存在较大的空腔,Tyr502容易发生构象翻转而迫使His479-Tyr502氢键断裂(图3C),而激动剂化合物14的异丙氧基可以稳定蛋白结构中His479和 Tyr502之间的氢键(图3B),这一氢键对于稳定AF2螺旋12(H12)的激动构象和维持RORγt受体激动功能至关重要。

图3. 化合物14-RORγt LBD对接模式图(A)、激动剂14(B)和反向激动剂2b(C)在RORγt LBD中的分子动力学模拟结果(蛋白H11-H12起始构象显示为白色,运行至1000ns的构象分别显示为蓝绿色和粉色)
复旦大学药学院药物化学系博士生鲁丽雪、博士黄亚飞和科研助理宋美旗为本论文的共同第一作者;复旦大学药学院谢琼副教授和王永辉教授为本论文的共同通讯作者。相关化合物已获得中国(CN108863850B)、美国(US10844017B)和日本(JP6953538B2)专利授权。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


