Nature子刊:新研究表明生物可降解T细胞增强支架可改善CAR-T细胞的抗肿瘤活性
来源:生物谷原创 2024-07-08 11:18
Mooney团队的这项研究展示了利用工程学模拟多细胞相互作用的能力,这种相互作用是我们的免疫系统抵御癌症的核心能力。这项技术可能将会大大改变许多接受CAR-T细胞治疗但尚未从中获益的癌症患者的生活。
CAR-T 细胞疗法正在改变对以前无法治愈的血癌的治疗。六种获批的 CAR-T细胞产品已为 2 万多人提供了治疗,500 多项临床试验正在进行中。然而,根据近期来自麻省总医院的一项研究,在100名接受CAR-T细胞疗法治疗的淋巴瘤、骨髓瘤或B细胞急性淋巴细胞白血病患者中,24%的患者只有部分反应,20%的患者完全没有反应,而这是接受CAR-T细胞疗法治疗的患者的典型成功率。
CAR-T 细胞是由患者自身的T 细胞通过引入所谓的“嵌合抗原受体(CAR)”而产生的,这些细胞表面上排列的CAR使它们能够寻找并杀死特定的癌细胞。经过费时费力、成本高昂的工程设计和体外扩增后,它们将作为活体疗法重新施用于相同患者。
科学家们猜测治疗效果令人失望可能是多种情况造成的,包括给患者注射的CAR-T细胞产品质量差,或者CAR-T细胞在患者体内的存活时间不够长,或者抗肿瘤能力衰竭。目前迫切需要新的治疗策略来帮助克服这些缺陷,并在 CAR-T 细胞的生产过程中甚至在患者体内进一步提高其质量和疗效。

如今,在一项新的研究中,来自哈佛大学维斯生物启发工程研究所和哈佛大学约翰-保尔森工程与应用科学学院的研究人员开发出一种生物可降解支架材料形式的简单干预措施,这种支架材料可以局部注射到皮下,用于在给送后重新刺激CAR-T细胞以提高其疗效。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Subcutaneous biodegradable scaffolds for restimulating the antitumour activity of pre-administered CAR-T cells”。
在患有侵袭性血液肿瘤的小鼠中,用非治愈剂量的CAR-T细胞治疗,这些作者开发的“T细胞增强支架(T-cell enhancing scaffold, TES)”显著抑制了肿瘤的生长,延长了这些小鼠的生存时间。CAR-T细胞治疗效果的提高是由于TES能够增加血液循环中CAR-T细胞的数量,并引导它们分化为杀伤肿瘤的T细胞亚型。
论文通讯作者、维斯生物启发工程研究所创始核心教员David Mooney博士说,“虽然我们的策略还需要根据人类的需求和环境进行转化,但它有可能为进一步改善反应不佳的患者的 CAR-T 细胞疗法提供一个安全、简单的途径。通过将CAR-T细胞制造过程的一部分转移到患者体内,它将来还有可能简化极其艰巨和昂贵的CAR-T细胞制造过程。”
目前已开发出许多 CAR-T 细胞刺激方法,除了引入 CAR 受体外,还对患者的 T 细胞进行了其他基因修饰,以更好地保持其疗效(细胞内在性),或者在疫苗的启发下,针对免疫系统的其他部分,支持 CAR-T 细胞攻击肿瘤细胞(细胞外在性)。
然而,这些方法大多涉及新的挑战,包括在 CAR-T 细胞制造过程中进行更复杂的细胞操纵,以及在细胞内在方法中控制所产生细胞的行为,或者在细胞外在方法中控制对人体产生意想不到的副作用。
在皮下构建假淋巴结(pseudo-lymph node)
论文共同第一作者David Zhang说,“在此之前,我们的团队设计了生物材料支架,通过模拟抗原递呈细胞(APC)在培养皿中扩增用于免疫疗法的T细胞,其中APC通常通过向淋巴结中的T细胞递呈肿瘤抗原来对其进行重编程。我们假设这一基本概念也可用于有效刺激体内的CAR-T细胞——TES本质上可以起到假淋巴结的作用。”
TES生物材料支架由微小的可生物降解介孔二氧化硅棒(mesoporous silica rod, MSR)组成,注入皮下后可自我组装成三维、细胞可渗透的支架结构,并通过小血管与血液循环相连。TES含有一种名为白细胞介素-2(IL-2)的可溶性分子,这种分子会持续释放,刺激从血液循环进入TES的T细胞增殖。
此外,MSR 还涂有双层脂质,以模拟 T 细胞在淋巴结中遇到的 APC 外细胞膜。这个脂质层将抗 CD3 和抗 CD28 这两种抗体分子呈现给 T 细胞表面上的 T 细胞受体,其方式与 APC呈递的肿瘤抗原通常刺激T 细胞受体的方式类似。这样,CAR-T 细胞的数量就会增加,并分化成杀伤肿瘤的T 细胞亚型。
图片来自Nature Biomedical Engineering, 2024, doi:10.1038/s41551-024-01216-4
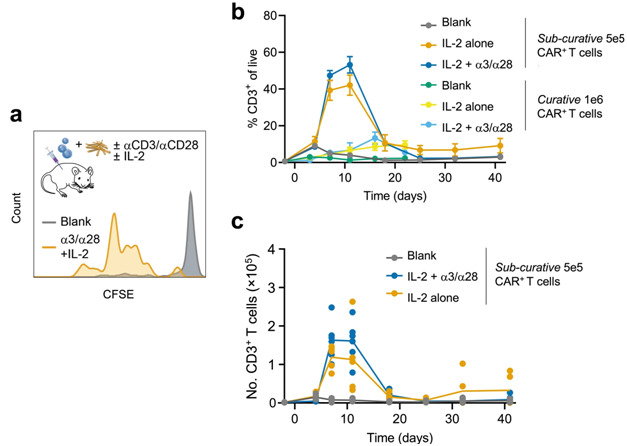
首先,这些作者确定了TES中抗CD3:抗CD28抗体的最佳比例和数量,这有助于招募最大数量的体外培养的CAR-T细胞,诱导它们成为具有杀伤肿瘤细胞潜能的“效应T细胞”。将 TES 注入小鼠皮下后,TES 会与动物的血管相连,并在三周多的时间内保持血管化结节的痕迹。
渗透进这种多孔网络的细胞中,60% 以上是中性粒细胞,这是一种充当免疫系统第一道防线的白细胞,而T细胞的比例要小得多,但也占了相当大的比例,T细胞通常是延迟的、靶向靶标特异性的肿瘤细胞(或病原体)的免疫防御系统的一部分。
论文共同第一作者Joshua Brockman博士说,这些作者认为认为,“通过引起一些轻微的炎症,TES支架刺激它们的血管化,并帮助吸引某些类别的免疫细胞,这将增加免疫细胞被动地通过TES。“通过在不同的时间点再次取出注射的TES支架,用CAR-T细胞进行培养,并测量这些细胞的活化水平,我们能够得出结论:TES支架可以在注射后至少七天内刺激CAR-T细胞。”
TES支架在肿瘤中的应用
为了测试TES作为治疗促进剂的潜力,这些作者使用了一种与临床相关的人类伯基特淋巴瘤小鼠模型,这是一种由B细胞癌变引起的可影响多个器官的血癌。他们首先给这些小鼠注射了人类淋巴瘤细胞,然后给它们注射了治疗剂量的针对这种肿瘤开发的 CAR-T 细胞,最后在动物皮下注射了 TES支架。
重要的是,含有IL-2、抗CD3和抗CD28因子的TES支架与缺乏这三种因子的空白TES相比,能使循环中的CAR-T细胞数量增加五倍以上,更多的CAR-T细胞获得了杀伤肿瘤细胞的潜能。在同样的情况下,当使用不足以治愈癌症的低剂量(亚治愈剂量)CAR-T细胞时,CAR-T细胞的增殖得更多。
Zhang总结说,“TES支架将CAR-T细胞吸收到其多孔结构中,促进其增殖、活化和分化,并最终进入血液,发挥其杀伤肿瘤的功能。重要的是,接受亚致死剂量CAR-T细胞和空白TES支架的淋巴瘤小鼠很快就会死于扩散的癌症,而注射了CAR-T细胞和全功能TES支架的淋巴瘤小鼠存活时间要长得多。”
Brockman补充说,“这种侵袭性淋巴瘤小鼠模型是提供概念验证的理想工具。然而,它对应的是处于这种疾病晚期的癌症患者,对他们的治疗需要大量的细胞毒性 T 细胞潜能。在将 TES支架进一步转化为人类患者体内使用的过程中,可能需要采用更持久、更平衡的方法,同时增强 CAR-T 细胞对肿瘤的记忆。”
维斯生物启发工程研究所创始董事Donald Ingber说,“Mooney团队的这项研究展示了利用工程学模拟多细胞相互作用的能力,这种相互作用是我们的免疫系统抵御癌症的核心能力。这项技术可能将会大大改变许多接受CAR-T细胞治疗但尚未从中获益的癌症患者的生活。” (生物谷Bioon.com)
参考资料:
David K. Y. Zhang et al. Subcutaneous biodegradable scaffolds for restimulating the antitumour activity of pre-administered CAR-T cells. Nature Biomedical Engineering, 2024, doi:10.1038/s41551-024-01216-4.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


