上海大学苏佳灿教授团队《Adv. Mater.》:开发普适性仿骨基质,实现编织骨类器官体外构建及全生命周期解析
来源:EFL生物3D打印与生物制造 2025-03-27 14:32
本研究聚焦于骨类器官构建的关键瓶颈问题,提出了一种基于动态仿骨基质的骨类器官构建策略,不仅为骨生物学研究提供了可扩展的类器官平台,也为骨组织再生开辟了全新的研究路径。
骨类器官作为体外三维骨组织模型,其核心价值在于精准复现天然骨组织的多级有序结构及其复杂的生理功能。骨类器官的体外发育过程涉及一系列高度协调的生物学事件,包括细胞自组织、成骨分化、基质分泌及生物矿化等。这一级联发育过程在机制上与自然界中珊瑚虫的自组织造礁、蚁群的涌现性筑巢等进化驱动的自主构建过程具有一定相似性,均依赖复杂的内在调控机制。然而,这些动态调控机制难以通过传统的工程手段精确模拟,从而限制了骨类器官的构建效率及其功能成熟度。
目前,制约骨类器官构建的核心瓶颈在于,传统生物材料缺乏对骨基质动态力学特性的精准模拟,导致三维培养体系中细胞的生长、分化及功能成熟受限。因此,开发兼具生化特性与动态力学适应性的仿生骨基质,以实现细胞行为与材料特性的动态耦合,成为突破骨类器官自主发育及功能重建技术壁垒的关键策略。
基于此,上海大学苏佳灿教授团队提出了一种创新性的骨类器官构建策略,基于材料生物学效应,突破传统工程设计模式,开发了普适性仿骨基质,成功构建兼具结构特征和功能活性的编织骨类器官,为骨组织工程与再生医学提供了全新的解决方案。
该研究以“Dynamic GelMA/DNA Dual-Network Hydrogels Promote Woven Bone Organoid Formation and Enhance Bone Regeneration”为题发表在了《Advanced Materials》上。上海大学转化医学研究所苏佳灿教授、姜莹莹副研究员与上海交通大学医学院附属新华医院王建华主任医师、王光超副主任医师为通讯作者,上海大学朱梦茹,新华医院张浩,新华医院周启荣,新华医院盛世豪为共同一作。

【兼具生化特性与动态力学适应性的仿骨基质开发】
该研究基于仿生策略,模拟天然骨基质的生物化学特征与动态力学特性,成功开发了一种GelMA/DNA双网络水凝胶(CGDE)。CGDE水凝胶具有优异的孔隙结构、适宜的力学强度及良好的应力松弛特性(图1)。其成胶机制依赖于DNA的物理自组装与GelMA的光引发聚合双重作用,且DNA与GelMA通过分子间氢键相互作用,实现了机械强度与黏弹性之间的动态平衡(图2)。此外,为匹配骨发育所需的生化线索,进一步引入仿生线粒体矿物(EACP)及过氧化氢酶(CAT)调控微环境,从而构建具有生物活性的CGDE仿骨基质。CGDE水凝胶表现出优异的生物相容性,能够显著促进骨髓间充质干细胞(BMSCs)的成骨矿化,并具备抗炎及成管功能活性(图3)。该仿骨基质的成功开发有望成为普适性骨类器官基质,为骨组织工程的进一步发展提供重要支撑。
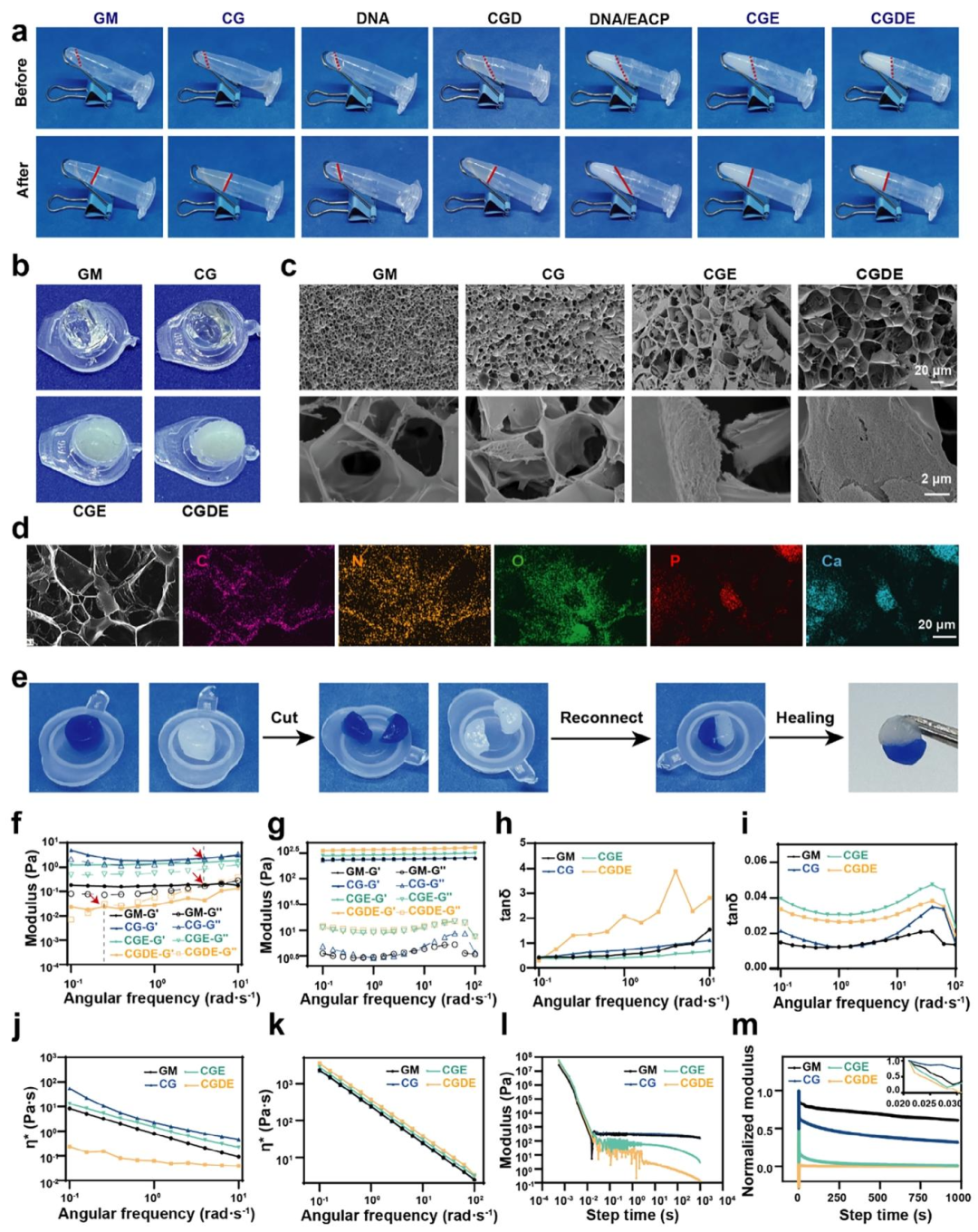
图1.GelMA/DNA双网络水凝胶的理化性能表征
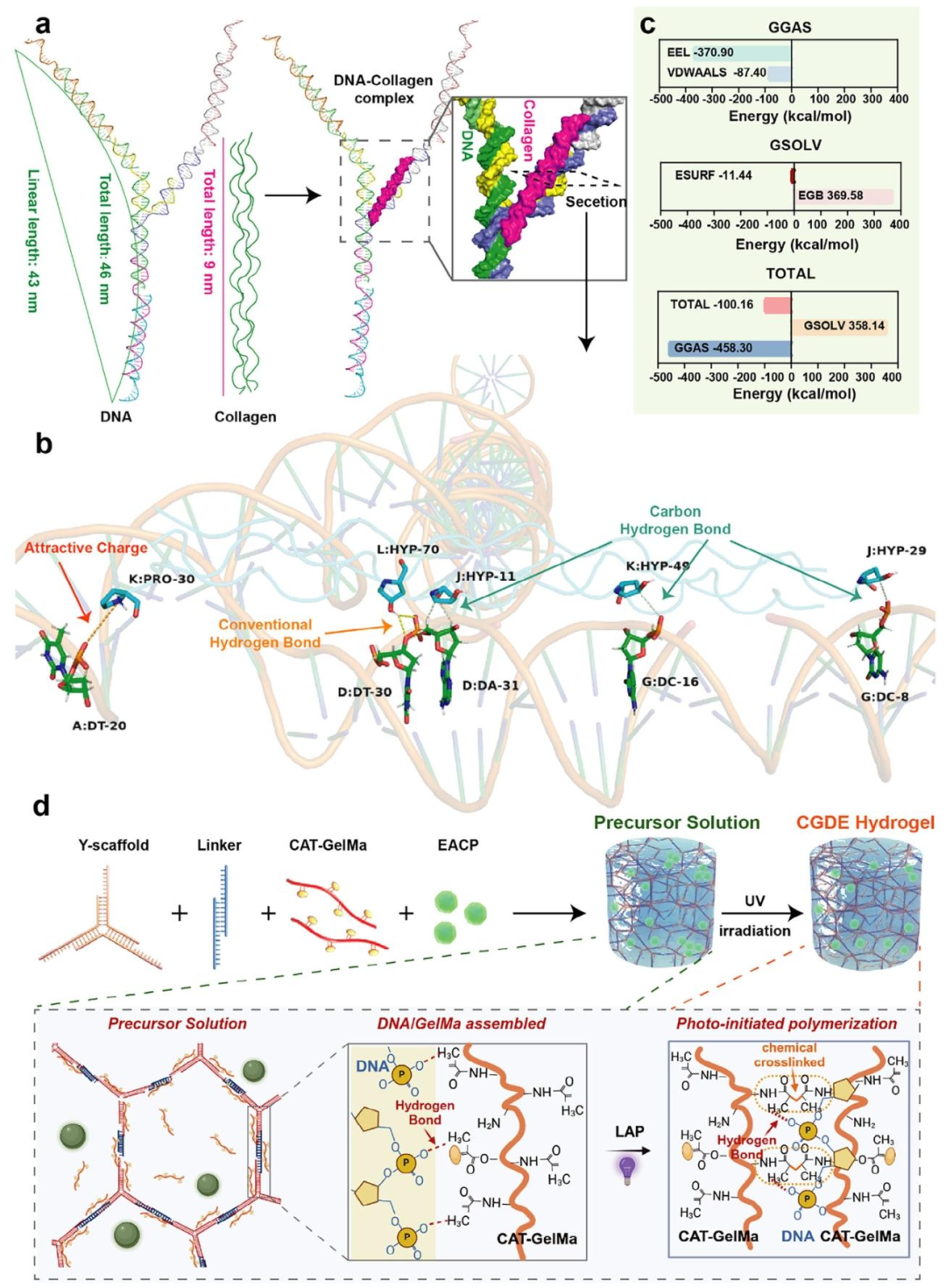
图2. GelMA/DNA双网络水凝胶的成胶机制
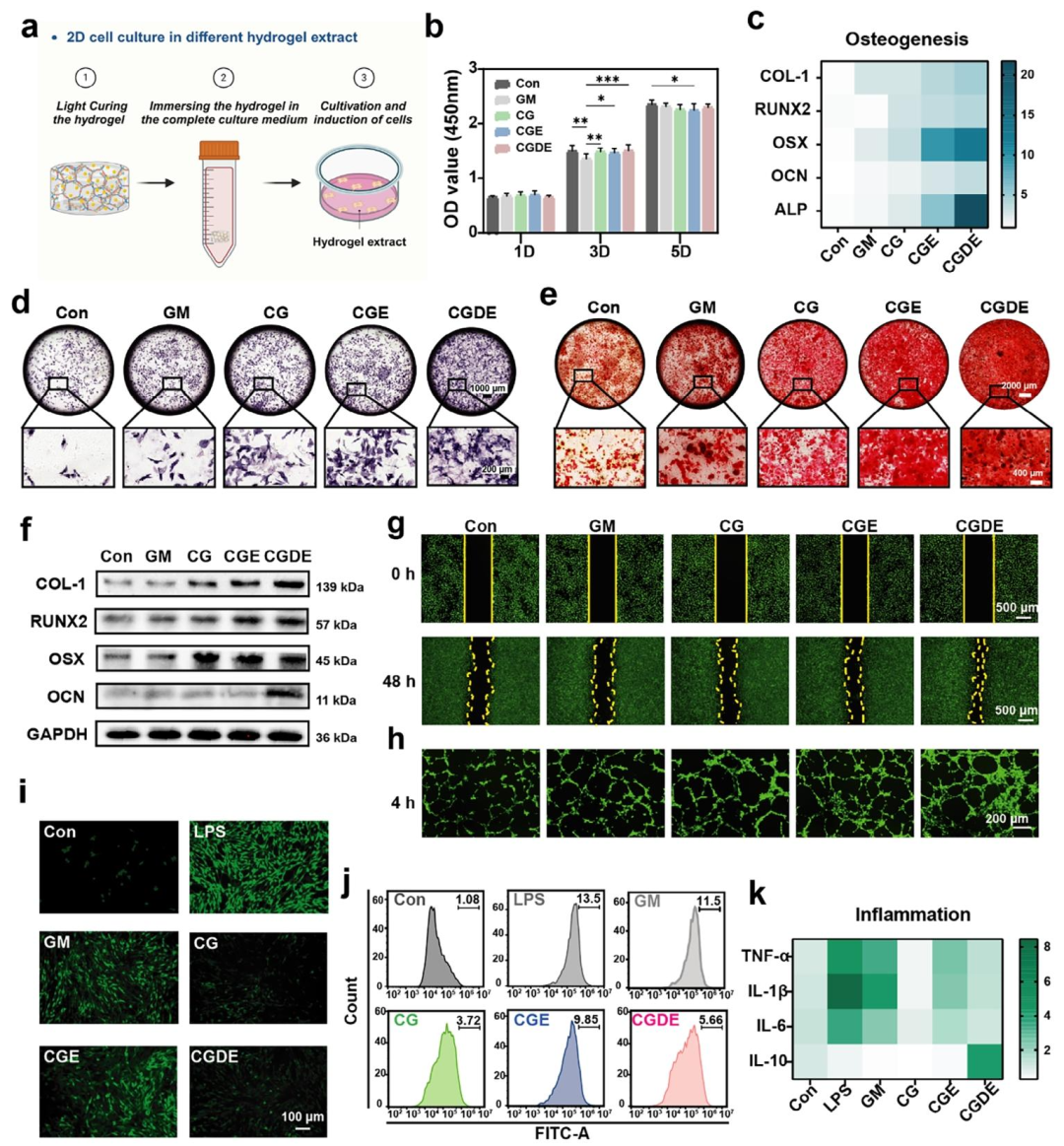
图3.GelMA/DNA双网络水凝胶的生物相容性和功能活性
【编织骨类器官的体外构建及全生命周期解析】
骨类器官的发育受细胞、基质材料、生长因子及动态微环境的精细调控,因此,其标准化构建不仅依赖于适宜的仿骨基质开发,还需建立系统化的体外诱导培养体系。基于此,该研究选用BMSCs作为种子细胞,并将其均匀混悬于CGDE前驱液中,通过光固化技术快速制备三维复合构建体。在成骨诱导培养体系中,系统探索骨类器官的全生命周期及其结构与功能的阶段性演变。
如图4所示,基于CGDE水凝胶构建的骨类器官(CGDE-21C)展现出最佳的细胞活性,形成均匀分布的细胞骨架网络,并表现出优异的血管化潜能及ROS清除能力。经过21天的体外成骨诱导,该构建体成功发育为前成骨细胞、成骨细胞及骨细胞共嵌于矿化胶原基质中的编织骨类器官。
进一步研究表明,编织骨类器官的体外发育过程遵循胚胎骨骼发育模式,呈现显著的自组织特性,细胞增殖、迁移及分化的动态过程伴随着矿化及组织重塑,最终形成具有时空异质性的类骨组织结构(图5)。该研究首次系统归
纳了编织骨类器官的阶段性演化规律:
1.适应启动期(0-7天):细胞初步聚集成球,骨架组装,基质矿物降解,力学强度降低。
2.增殖性自组织期(7-14天):细胞网络逐步形成,矿物降解释放矿物离子,促进成骨矿化,力学强度回升。
3.结构成熟期(14-21天):细胞活性达到峰值,成骨谱系细胞建立通讯网络,基质重塑为矿化胶原,力学强度显著增强。
4.终末矿化期(21-30天):细胞成骨分化进入终末阶段,细胞活性下降,骨架断裂,基质全面矿化并逐步崩解,力学强度再次降低。
研究结果表明,CGDE可作为普适性骨类器官基质,调控组织内细胞的自组织化及器官结构的自然发生。由CGDE衍生的编织骨类器官不仅具有高度仿生的组织结构,还展现出优异的生物功能活性,有望作为新型植入材料促进骨再生与修复。
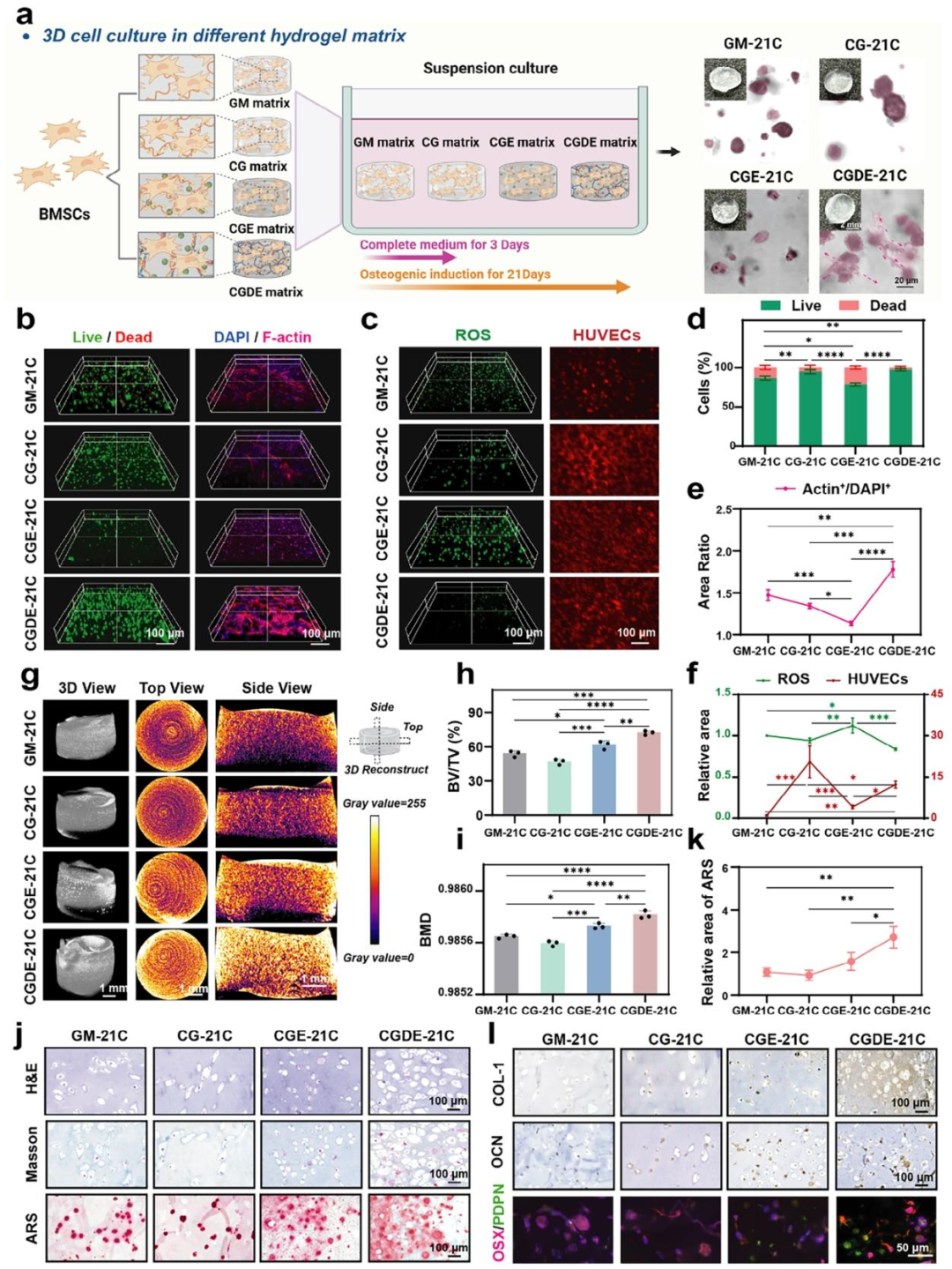
图4.用于骨类器官三维培养的基质水凝胶评估
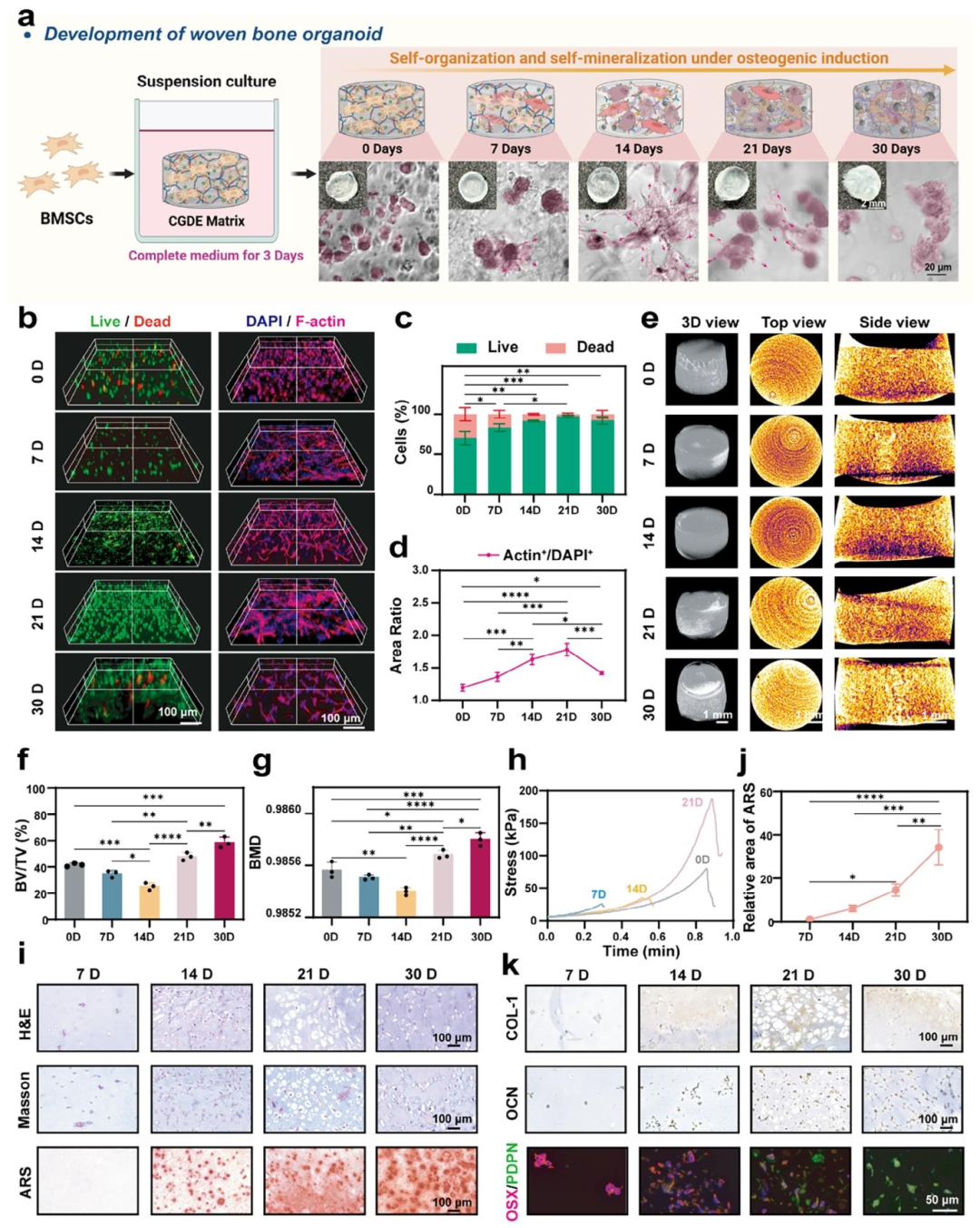
图5. 编织骨类器官的全生命周期探索
【编织骨类器官的成骨活性及机制探索】
不同发育阶段的骨类器官在结构特征和功能活性上存在显著差异,这种异质性进一步影响其在骨再生修复中的应用潜力。为深入探究不同发育阶段编织骨类器官的成骨能力,该研究通过裸鼠皮下异位成骨实验及大鼠颅骨缺损修复实验,系统评估其在体内的骨改建过程、骨再生修复活性,并进一步解析其成骨机制。
体内实验结果表明,CGDE衍生的编织骨类器官具备自主成骨潜力,不依赖于宿主成骨微环境。植入皮下后,该类器官能够通过血管化促进基质重塑,快速完成骨改建,并最终形成成熟的板层骨(图6)。转录组测序分析(图7)进一步揭示了CGDE的作用机制:CGDE能够增强类器官内线粒体ATP生物合成,促进细胞骨架重构,并通过激活MAPK和JNK-STAT信号通路,建立仿生矿化微环境诱导的骨再生调控模式(图8)。
此外,在骨缺损修复实验中,编织骨类器官表现出优异的自适应能力,能够适应骨损伤环境并促进骨再生。其中,成骨诱导21天的编织骨类器官的骨修复活性最佳,作为成骨模板可在4周内实现快速骨整合,并在12周内完成功能性骨重建(图9)。
以上结果表明,编织骨类器官具备高度自主的成骨潜力,在体内进一步发育与改建后,可有效促进骨缺损的快速整合与修复,为骨再生医学提供了一种创新性的生物工程策略。
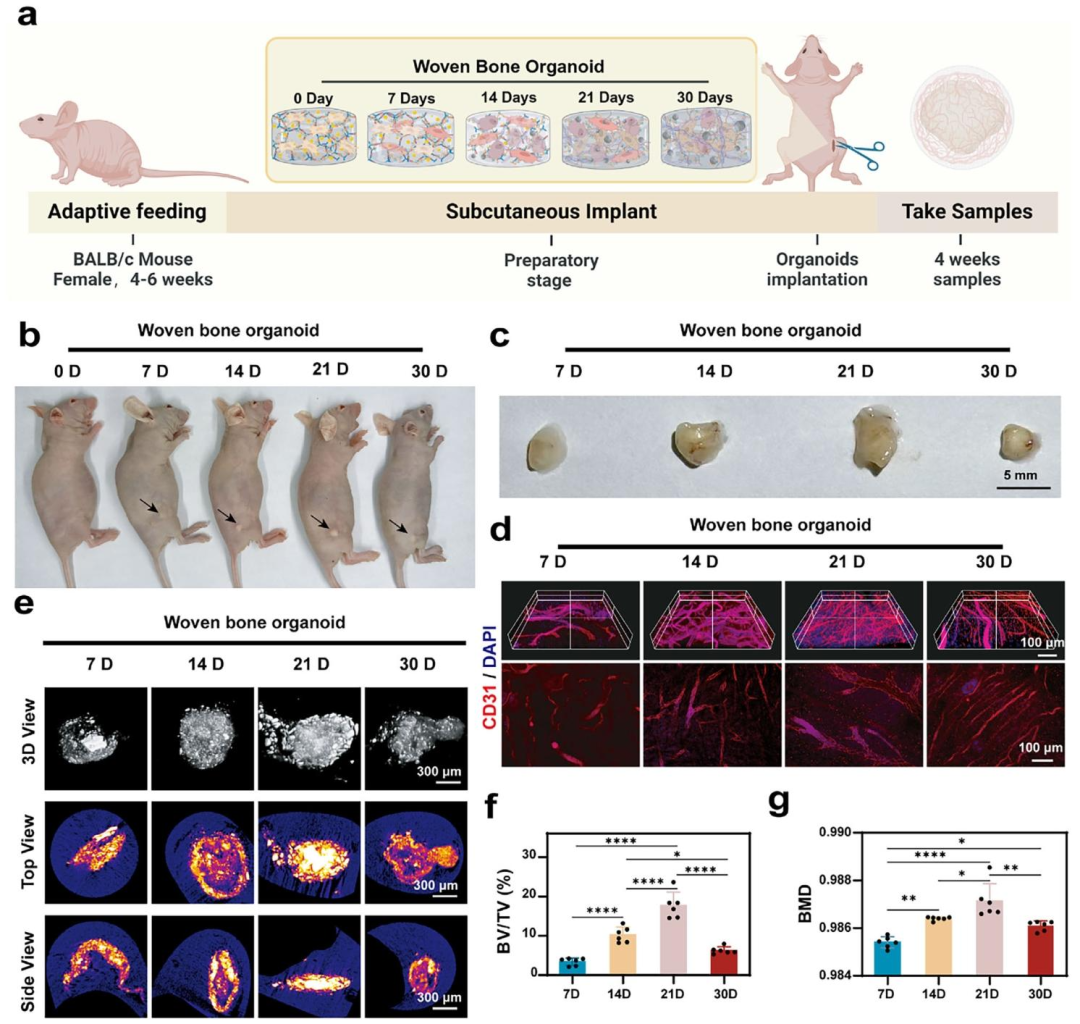
图6. 不同发育阶段编织骨类器官的异位成骨活性评价
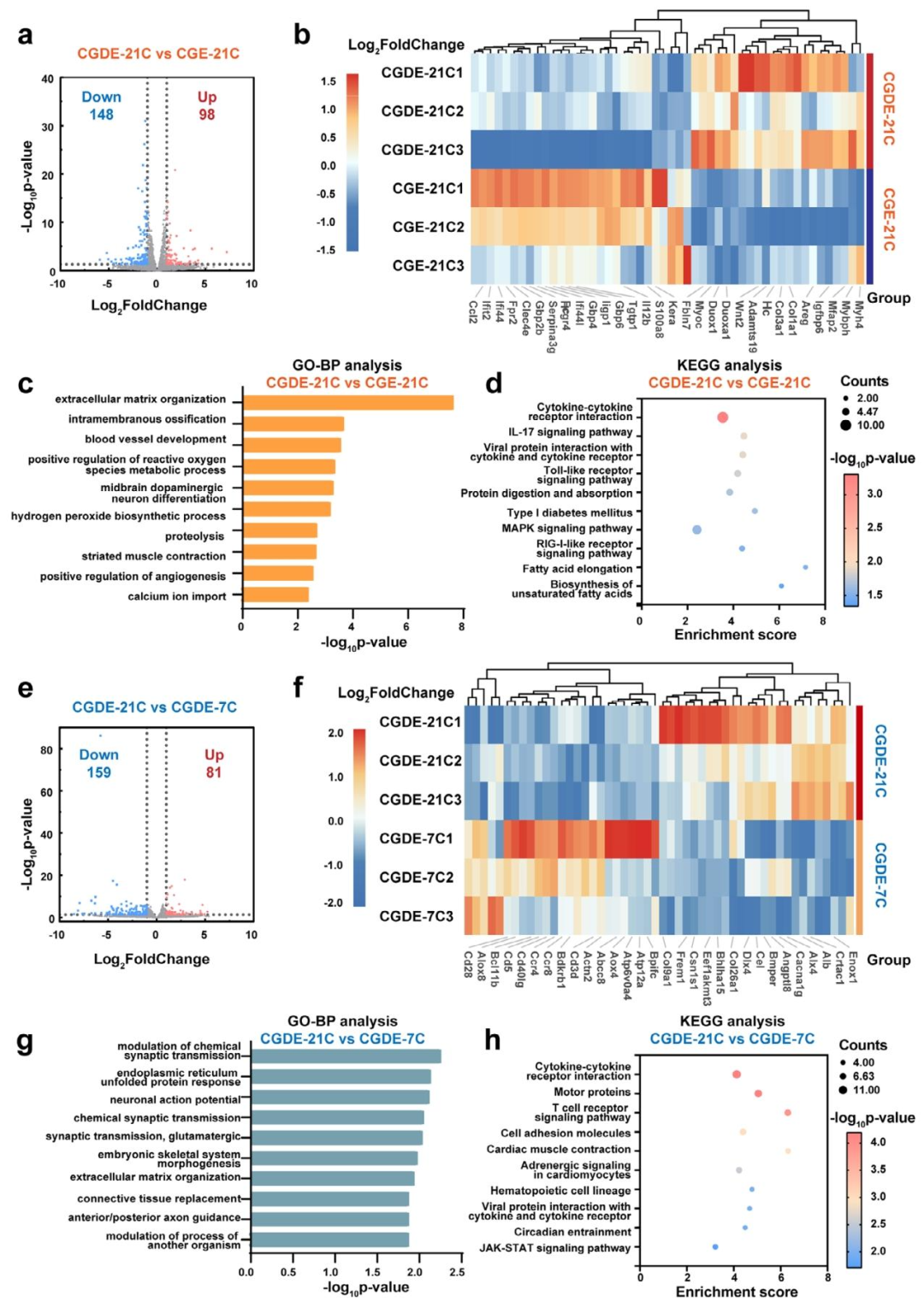
图7. 编织骨类器官的转录组测序分析
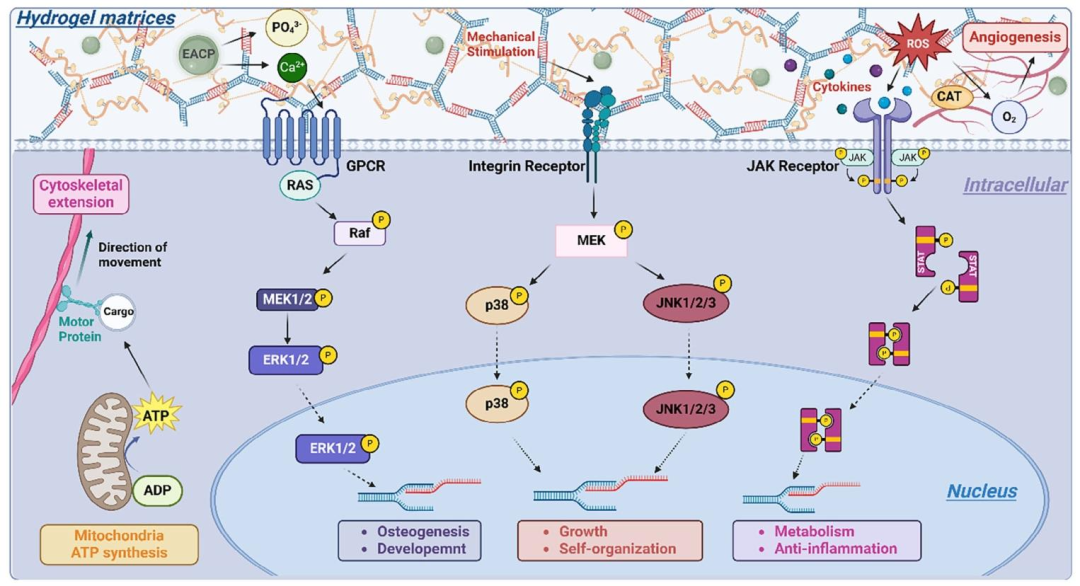
图8. CGDE水凝胶衍生的编织骨类器官发育的机制
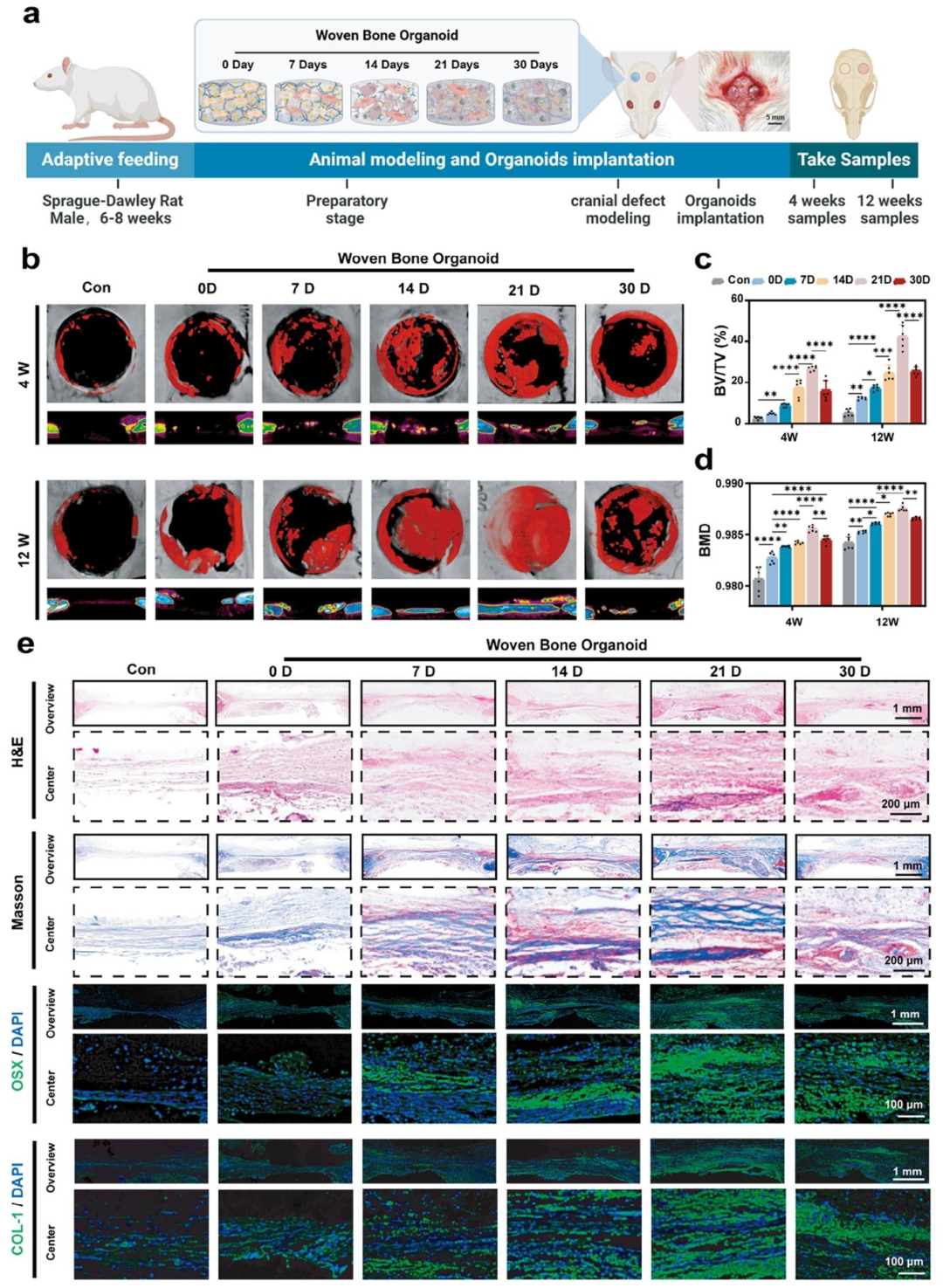
图9. 编织骨类器官的体内骨修复活性评价
【结论与展望】
本研究聚焦于骨类器官构建的关键瓶颈问题,提出了一种基于动态仿骨基质的骨类器官构建策略,不仅为骨生物学研究提供了可扩展的类器官平台,也为骨组织再生开辟了全新的研究路径(图10)。此外,编织骨类器官的成功构建为骨再生机制研究和骨病模型构建提供了重要范式,并进一步推动骨类器官向更高精度的病理型(2.0)、结构型(3.0)、复合型(4.0)及应用型(5.0)方向发展,加速其在再生医学和临床转化中的应用。
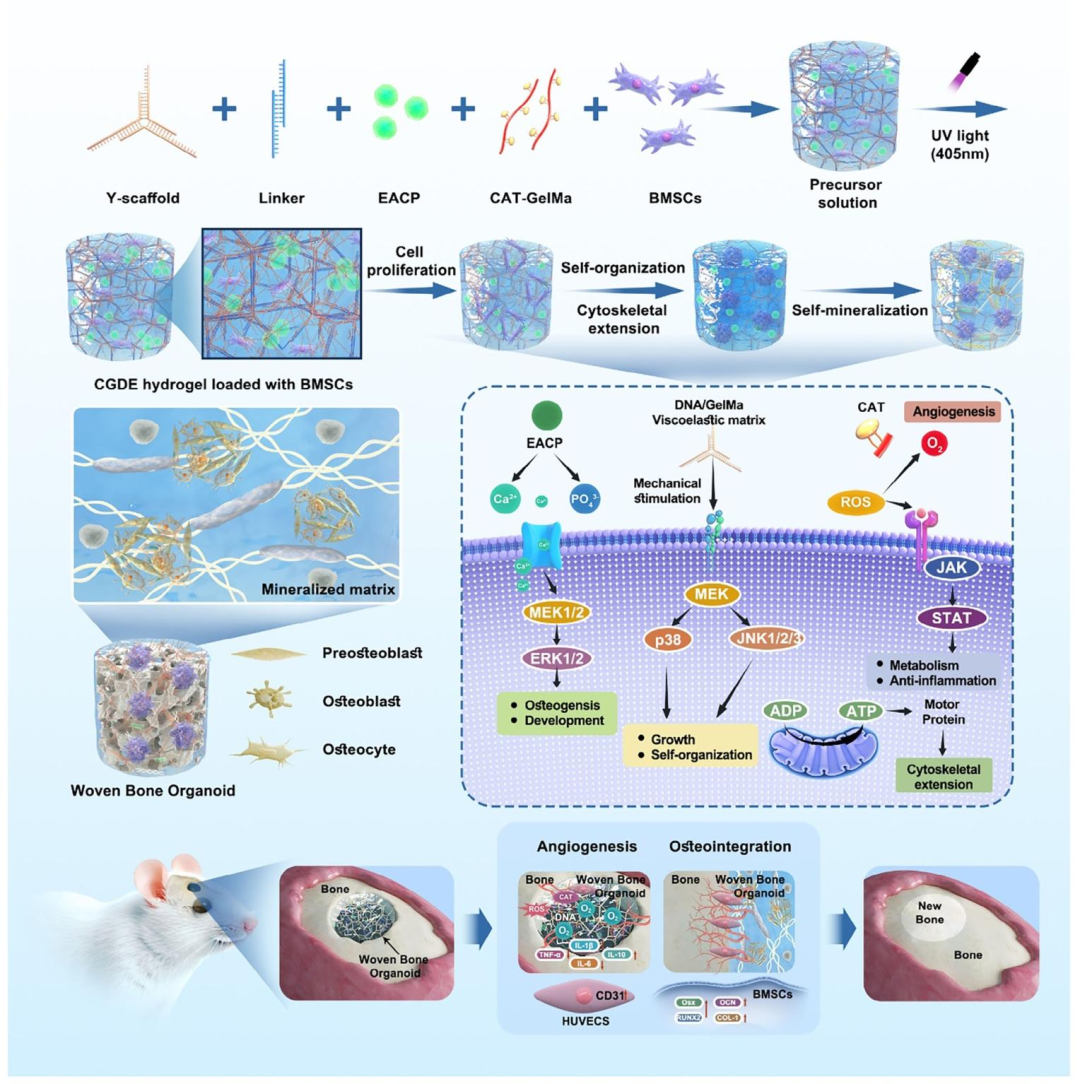
图10. 动态CGDE水凝胶的设计和CGDE衍生的编织骨类器官的开发和应用
文章来源:
https://doi.org/10.1002/adma.202501254
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


