无需“载体”也能精准抗癌!J Nanobiotechnology:新型无载体纳米颗粒精准锁瘤,化疗免疫协同发力,联合治疗抑生长防转移
来源:生物谷原创 2025-07-14 08:56
本研究开发的DPA纳米颗粒能靶向肿瘤,诱导免疫原性细胞死亡并激活免疫反应,抑制肿瘤生长、转移和复发,与免疫检查点抑制剂联用效果更佳,是有临床转化潜力的精准联合治疗平台。
在全球范围内,癌症依旧是威胁人类健康的重大难题,尽管肿瘤治疗领域已取得不少进展,但传统疗法在疗效、靶向性和安全性等方面仍存在局限,亟需创新治疗策略。近期,J Nanobiotechnology发表了一项关于新型纳米药物的研究A novel carrier-free nanoparticle with stable distinctive three-dimensional structure for tumor-targeted precision chemoimmunotherapy,为肿瘤精准化联合治疗带来了新希望。

研究团队开发了一种名为DPA NPs的新型无载体肿瘤靶向纳米药物系统,它由阿霉素(DOX)、肿瘤归巢肽iRGD、基质金属蛋白酶2(MMP2)响应肽和佐剂单磷酰脂质A(MPLA)通过自组装形成。这种纳米颗粒具有稳定独特的三维纳米结构和肿瘤微环境(TME)响应特性,能高效将DOX递送至肿瘤细胞,诱导免疫原性细胞死亡(ICD),同时触发肿瘤特异性免疫反应,MPLA还能增强抗肿瘤免疫力,显著抑制肿瘤生长和转移,与免疫检查点抑制剂(ICIs)联合使用时,在B16黑色素瘤模型中进一步提升了治疗效果,能有效抑制肿瘤生长、转移并预防复发。
在制备与表征方面,DPA NPs通过自组装策略形成,DOX在其表面呈放射状排列。透射电镜显示其为均匀球形,动态光散射测得平均直径约163.2±1.9 nm,多分散指数0.129±0.09,zeta电位-28.4±0.6 mV,对DOX和MPLA的包封率分别为11.96±0.001%和18.76±0.002%。稳定性测试表明,它在PBS中可稳定超过35天,在含10%胎牛血清的RPMI培养基中约稳定15天。对MMP2酶响应性良好,接触后直径和多分散指数显著增加,zeta电位绝对值降低,在模拟肿瘤细胞内还原性环境中,一天内可释放约85%的DOX,远高于无酶处理情况,展现出对TME和细胞内环境的高敏感性。
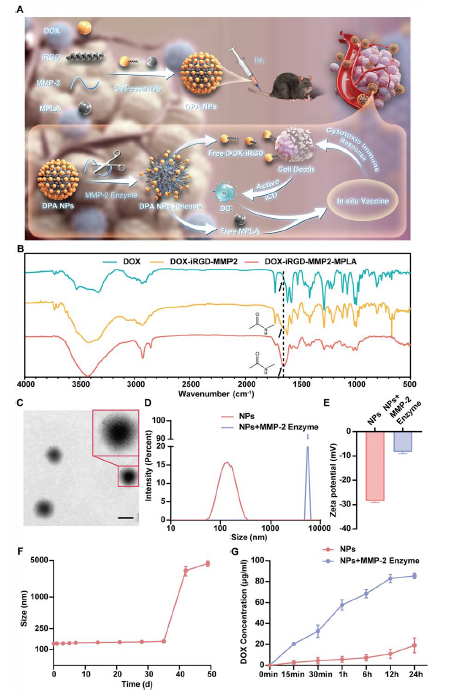
图 1:DPA NPs的设计与表征
体外实验中,DPA NPs对人脐静脉内皮细胞(HUVECs)的毒性低于游离DOX,安全性更优。经MMP2酶预处理后与B16肿瘤细胞共孵育,能显著降低肿瘤细胞活力,有效抑制Ki67表达,减少肿瘤细胞增殖。在细胞摄取方面,B16细胞对经MMP2酶处理的DPA NPs释放的DOX摄取量与游离DOX相当,保证了药效发挥。同时,DPA NPs能有效促进骨髓来源树突状细胞(BMDCs)成熟和活化,上调MHC-I、MHC-II及共刺激分子CD40、CD86的表达,增加IFN-γ和TNF-α等细胞因子的分泌,增强免疫反应。
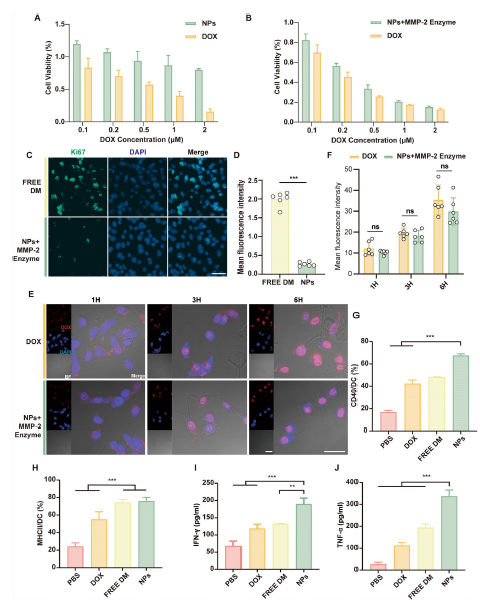
图 2:DPA NPs的体外细胞毒性、细胞摄取和免疫激活特性评估
机制研究发现,与游离DOX和MPLA组合(free DM)相比,DPA NPs处理的B16细胞有462个基因上调,450个基因下调。定量PCR证实免疫应答和肿瘤凋亡相关基因如Myd88、P53、Jund、Irf-5显著上调,KEGG和GSEA分析显示免疫相关信号通路如MAPK、TNF、NOD样受体、Toll样受体、P53和NF-κB通路被显著激活。DPA NPs能更有效诱导ICD,增加细胞表面钙网蛋白(CRT)暴露、ATP分泌和高迁移率族蛋白1(HMGB1)释放,这些损伤相关分子模式(DAMPs)能有效激活免疫系统,增强抗肿瘤免疫。
体内研究中,在B16黑色素瘤小鼠模型中,DPA NPs在肿瘤组织中积累更多,在非靶器官分布较少,且在肿瘤部位保留时间更长。与PBS、游离DOX及free DM相比,显著抑制肿瘤生长,降低肿瘤重量,诱导肿瘤细胞凋亡更明显,且对心脏毒性显著降低,肝、肾、脾等器官无明显病理变化。
对免疫细胞分析显示,DPA NPs处理组小鼠脾脏和淋巴结中CD3+CD4+和CD3+CD8+ T细胞比例显著升高,CD4+Ki67+和CD8+Ki67+ T细胞比例增加,促进T细胞增殖和活化。在转移预防方面,DPA NPs处理小鼠的脾淋巴细胞对B16肿瘤细胞的杀伤能力更强,肺转移模型中转移结节数量显著减少。与抗PD-1抗体联合使用时,抗肿瘤效果进一步增强,部分小鼠肿瘤几乎消失,生存期延长,肿瘤组织中CD3+CD4+和CD3+CD8+ T细胞比例及IFN-γ、TNF-α水平更高。在术后复发模型中,DPA NPs单药及与抗PD-1联合使用均能显著抑制肿瘤复发,增加中枢记忆T细胞(Tcm;CD62LhiCD44hi)比例,增增强长期免疫监视能力。
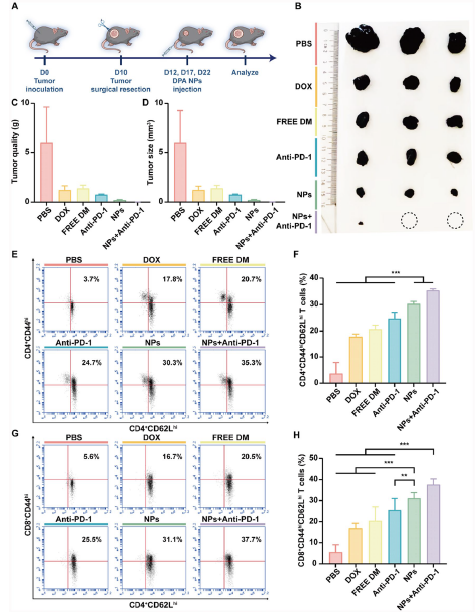
图 3:DPA NPs在术后免疫治疗中对肿瘤复发的抑制作用
总的来说,DPA NPs作为一种新型无载体纳米药物系统,集化疗与免疫治疗于一体,靶向性强,能响应肿瘤微环境,有效抑制肿瘤生长、转移和复发,与免疫检查点抑制剂联合使用效果更佳,为肿瘤精准联合治疗提供了多功能纳米平台,具有广阔的临床转化潜力,有望为癌症患者带来新的治疗选择,改善癌症治疗的现状和患者的预后。(生物谷Bioon.com)
参考文献:
Deng B, Kong Y, Ma Y, et al. A novel carrier-free nanoparticle with stable distinctive three-dimensional structure for tumor-targeted precision chemoimmunotherapy. J Nanobiotechnology. 2025;23(1):480. Published 2025 Jul 1. doi:10.1186/s12951-025-03568-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


