家族性帕金森病的研究获进展
来源:上海有机所 2021-11-09 16:13
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组在Nature Communications上,发表了题为The hereditary mutation G51D unlocks a distinct fibril strain transmissible to wild-type α-synuclein的研究成果。该研究发现α-sy
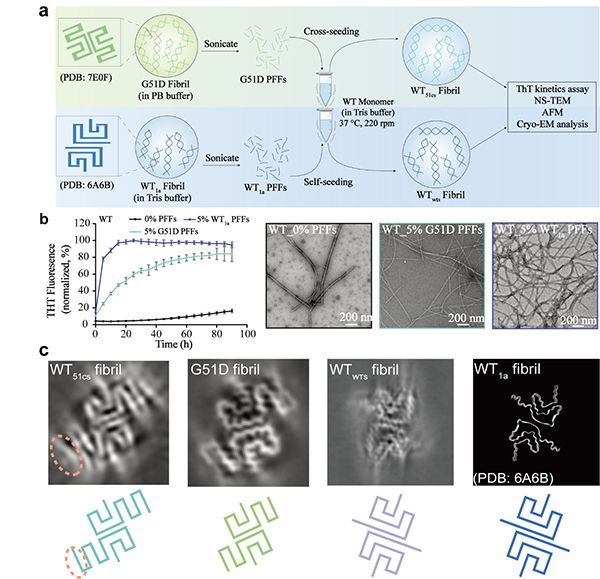
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组在Nature Communications上,发表了题为The hereditary mutation G51D unlocks a distinct fibril strain transmissible to wild-type α-synuclein的研究成果。该研究发现α-syn遗传突变G51D可形成一种全新的α-syn病理纤维类型(strain)。这种新的G51D strain具有比WT strain更低的结构稳定性和更强的细胞毒性,并可以通过交叉接种(cross-seeding)的方式诱导WT α-syn形成类似于G51D strain的聚集。
α-Syn蛋白的病理性淀粉样聚集是帕金森病(Parkinson’s disease,PD)及多种突触核蛋白病的主要病理标志,这种病理性聚集在细胞间的传递和脑区间的扩散是PD病理机制中的重要部分。已有研究发现α-syn单位点的遗传突变(G51D、A53T、E46K等)是家族性PD(fPD)的重要驱动因素,探究α-syn单位点遗传突变如何影响其病理性聚集对于阐释fPD的病理机制至关重要。
科研人员首先表征了G51D α-syn strain的理化和病理性质,发现G51D strain具有不同于WT strain的右手螺旋构象,并具有较低的纤维结构稳定性;G51D strain具有更强的细胞毒性,且可诱导神经元内源α-syn形成更多聚集(图1)。研究人员进一步利用冷冻电镜技术解析了G51D strain的高分辨率结构,发现G51D strain形成了与WT strain不同的具有更小的纤维核心的结构。该构象与之前发现的E46K strain具有相似性,不同的是51位点的突变破坏了E46K strain中原有的由残基45-53组成的β-发夹。
目前,研究已发现携带G51D突变的fPD病人均是杂合突变,WT与G51D α-syn共同存在于体内。那么,G51D strain是否影响WT α-syn纤维的组装?cross-seeding实验发现,G51D的纤维种子可以加速WT α-syn单体的聚集,并诱导WT单体形成与G51D strain相同的右手螺旋纤维。研究利用三维电镜重构进一步发现,G51D strain的种子能够诱导WT α-syn形成G51D strain的构象(图2)。因此,更强细胞毒性的G51D strain可能会扩散到WT α-syn,从而协同加速fPD病人的病程。
此外,研究还发现,相比于WT和G51D单体独立自组装体系,WT和G51D二者混合能显着增强系统中蛋白淀粉样聚集的能力。WT和G51D α-syn能够共同组装形成具有新结构特征的纤维,而其中的共组装分子机理研究仍在进行。综上,该研究推进了关于遗传突变和WT α-syn淀粉样纤维组装机制以及不同病理性strain选择性问题的研究,为探究α-syn病理性淀粉样纤维组装机制和fPD致病机理的研究提供了新视角。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


