Nat Commun│中国科学院管敏团队发现靶向脂肪细胞ESRRA可促进富含脂肪细胞的骨髓中的成骨和血管形成
来源:生物探索 2024-05-12 11:02
研究表明脂肪细胞ESRRA缺乏可以保护小鼠免受HFD或卵巢切除术(OVX)引起的骨质流失和高骨髓肥胖,而对外周WAT几乎没有影响。
中国科学院深圳先进技术研究院管敏团队在Nature Communications 发表题为“Targeting adipocyte ESRRA promotes osteogenesis and vascular formation in adipocyte-rich bone marrow”的研究论文,该研究表明脂肪细胞特异性ESRRA缺乏在雌激素缺乏或肥胖时保留了富含脂肪细胞的骨髓中的成骨和血管形成。
机制上,脂肪细胞 ESRRA 干扰 E2/ESR1 信号传导,导致分泌磷蛋白1(Spp1)的转录抑制;然而,通过与其启动子结合来正向调节瘦素的表达。ESRRA消除导致内脏脂肪细胞和BMAds的 SPP1 增强和瘦素分泌减少,共同决定骨髓基质干细胞的命运承诺并恢复 H 型血管形成,构成骨形成的前馈环。ESRRA的药理学抑制可保护肥胖小鼠免受骨质流失和高骨髓肥胖的影响。因此,研究结果强调了一种通过靶向脂肪细胞ESRRA来保持骨形成的治疗方法,特别是在有害的富含脂肪细胞的骨环境中。

哺乳动物骨髓由多种细胞类型组成,如脂肪细胞、成骨细胞、破骨细胞、基质细胞和血管细胞。这些细胞的相互作用为骨髓骨骼干细胞(BMSC)和其他谱系细胞的分化提供了关键的调节环境,进而维持了复杂的稳态系统,用于骨微环境中的重塑和再生。众所周知,骨髓脂肪细胞(BMAds)起源于 BMSC,而BMSC 也会产生成骨细胞和骨细胞。在健康成年人中,骨髓脂肪组织(MAT)约占总脂肪量的 10% 和全骨髓体积的约 70%。然而,BMAds 的过度积累通常发生在不同的临床状况中。MAT扩增可能会夸大有害的骨微环境,使疾病进展恶化。然而,过度BMAds的确切机制,特别是在介导骨驻留细胞通讯的病理生理条件的响应中仍然难以捉摸。
脂肪组织是调节全身能量稳态的核心。与白色脂肪组织(WAT)类似,正常 MAT具有能量储存功能,可以释放游离脂肪酸 (FFA) 以支持运动刺激的骨骼形成。然而,MAT 在热量限制下迅速膨胀,表明 MAT 与外周脂肪组织不同。此外,高脂肪饮食(HFD)还通过作用于瘦素受体表达(LepR+) BMSC 的循环瘦素来促进脂肪生成并抑制 BMSC 的成骨,从而迅速增加 MAT 的扩张。因此,由于病理生理条件导致的骨微环境中的异常信号传导以牺牲骨祖细胞为代价,将 BMSC 谱系分配给固定的成脂祖细胞,从而导致骨骼退化是合理的。最近的研究表明,累积的BMAds 有助于循环信号因子和几种众所周知的脂肪因子,以应对肥胖、衰老或热量限制。这些来自外周WAT或MAT的分泌因子可能会进一步影响骨稳态。
BMAd位于骨环境中,与血管和造血组织密切接触。成骨与骨血管生成密切相关;特别是,干骺端称为 H 型血管的特定毛细血管内皮细胞(EC)亚型与干骺端-骨干界面的骨髓脉管系统有关。糖皮质激素引发的 BMAds 衰老导致周围血管细胞和成骨细胞继发性衰老,导致骨缺损。在患有骨质疏松症的老年人和绝经后妇女中也观察到异常的 H 型血管,这通常伴随着骨髓肥胖的增加。事实上,富含脂肪细胞的骨髓被认为对照射后的造血有明显的负面影响。
然而,由脂联素重组酶 (Adipoq-Cre) 标记的祖细胞产生的 BMAds 最近被确定为干细胞因子(SCF 或 KitL)的来源,这是年轻成年小鼠正常造血所必需的。此外,Scf 转录本在来自年轻供体的人骨髓的 BMAds 中高度富集,表明 BMAds 在正常骨髓微环境中起着重要作用。最近基于单细胞 RNA-seq 的证据进一步表明,Adipoq 标记的骨髓脂肪细胞亚群对于支持骨髓脉管系统至关重要。因此,BMAds 作为维持骨髓微环境的生态位成分具有上下文依赖性功能。
孤儿核受体雌激素相关受体α(ESRRA)是控制能量平衡和代谢的重要转录因子。具体来说,ESRRA在对禁食、卡路里限制、寒冷暴露或营养过剩的应激反应中是必需的。之前发现,由于空腹小鼠中富含甘油三酯的肝脏极低密度脂蛋白分泌变钝,肝脏特异性ESRRA敲除导致血脂水平降低。ESRRA还被描述为一种关键介质,参与调节昼夜代谢节律依赖性肠脂质吸收、偶联细胞代谢和肾近端小管分化或控制肝脏代谢以响应胰岛素作用和抵抗。
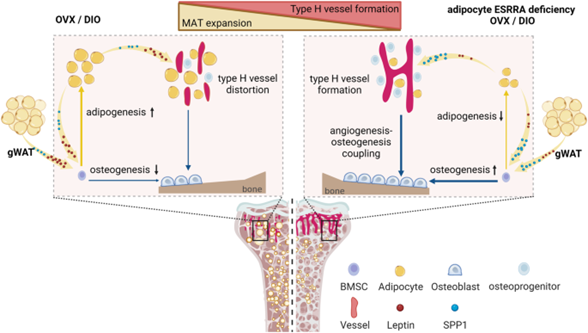
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


