研究发现新类型非编码RNA调控RNA剪接和修饰
来源:网络 2023-05-06 10:08
研究团队进一步通过对四组删除不同区域的bktRNA1-KO细胞进行RNA-seq测序及剪接分析,发现敲除bktRNA1影响超过75%的U12型内含子剪接。
RNA除了用来合成蛋白质的遗传密码之外,还嵌入了第二层遗传信息—即RNA高级结构和序列基序1。因此,揭示具有特定结构和序列基序(motif)的新类型非编码RNA (ncRNA) 及其功能机制是理解细胞遗传信息传递的核心任务之一。NcRNA通常通过不同的二级或三级RNA结构基序与 RNA 结合蛋白 (RBP) 相互作用去执行调控功能。其中,Kink-turn (K-turn) 结构是一类几乎存在所有生物中的三级(3D)RNA结构基序,并广泛存在于mRNA与各类ncRNA中。K-turn结构及其结合蛋白15.5K在RNA代谢和疾病发生发展过程中发挥重要的调控功能。然而由于目前缺乏有效的实验与计算机技术去鉴定具有K-turn结构的RNA(ktRNA),因此K-turn结构在转录组中的分布、表达、结构特性及功能机制都有待全面阐释。
中山大学生命科学学院的杨建华和屈良鹄教授团队开发了RIP-PEN-seq/PEN-seq/sub-PEN-seq等测序技术和kturnSeeker算法发现在固定位置出现后向(backward)K-turn结构和序列基序的新类型ncRNA(bktRNA),并解析了它们的表达、折叠结构特性及其在RNA剪接和修饰中的功能机制,为发现新的ktRNA/ncRNA及其功能机制研究提供了新方法和新思路。
由于目前的RIP-seq和RNA-seq方法经常对长度大于50个核苷酸(nt)的RNA进行片段化及利用随机引物进行RT-PCR扩增后测序,从而导致这些方法无法测定全长的ncRNA和无法发现 ncRNA 上的序列和结构基序及其距离RNA末端的精确位置。针对这些问题,研究团队首先通过开发RIP-PEN-seq技术去测定人和小鼠中与15.5K蛋白互作的全长ncRNA分子(20-500个核苷酸),并进一步根据K-turn结构特性开发了kturnSeeker算法分析这些RIP-PEN-seq测序数据(图1)。kturnSeeker软件除了鉴定绝大多数已知的前向(forward) ktRNA(fktRNA)和600多个新的fktRNA,还发现390多个新的后向ktRNA。
研究团队通过结构和基序富集分析这些新的后向ktRNA,发现它们都具有以下的规律性特征:(1)具有后向K-turn结构基序;(2)后向K-turn结构基序具有距离这些ktRNA的5'端4个核苷酸和3'端2个核苷酸的规律;(3)后向K-turn结构的5'端包含了CUGA及3'端包含了UGAUG的保守基序。应用RIP-PEN-seq和kturnSeeker于小鼠的细胞同样发现以上的规律性特征。此外,研究团队进一步联合了RIP-PEN-seq和SHAPE-MaP等技术发展了RIP-PEN-SHAPE-MaP方法证实了后向ktRNA的确是以这3个结构和序列特征形成K-turn并与15.5K蛋白互作。因此基于这些规律性特征,它们被命名为具有规律性后向K-turn结构基序的新类型ncRNA(bktRNA)。
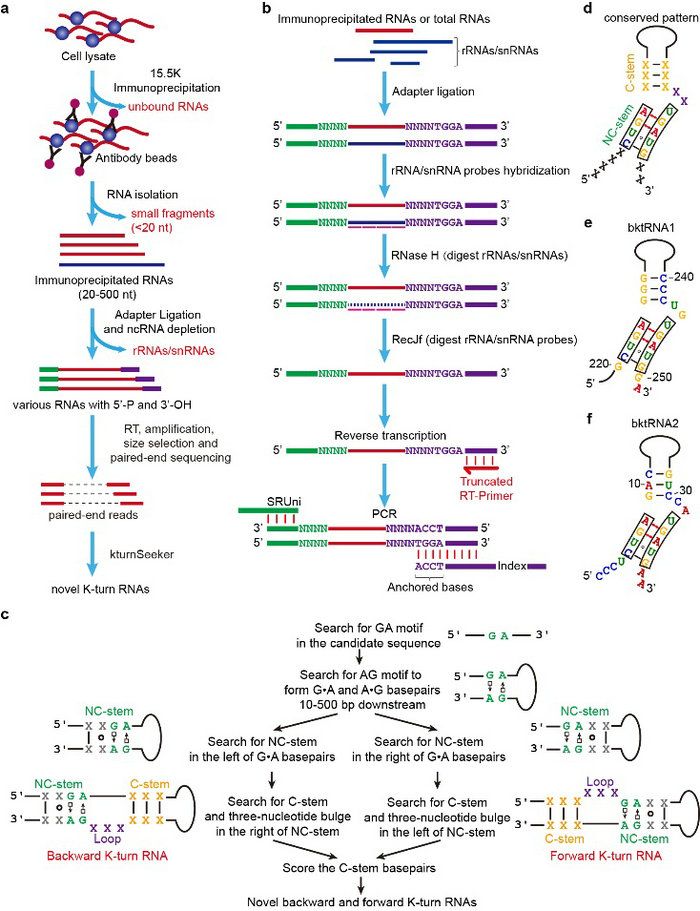
图1 开发新的RIP-PEN-seq测序技术和计算机算法kturnSeeker发现人类的bktRNA
研究团队进一步开发PEN-seq和sub-PEN-seq技术应用于人类各种细胞和亚细胞组分,并利用kturnSeeker分析这些和公共的测序数据鉴定了超过390个bktRNA,发现它们的长度范围从20到500个核苷酸,具有一定的组织细胞特异性,且主要分布于细胞核内。基于基因组结构和序列保守性分析,发现bktRNA主要位于各种基因的内含子区域;部分bktRNA在进化上是很保守的(bktRNA1从人到斑马鱼保守),但有很多人类的bktRNA只在灵长类保守。通过对bktRNA进行结构折叠(folding)特性分析发现它们与其它依赖金属离子折叠的ktRNA明显不一样,bktRNA的序列组成及其与15.5K蛋白的互作可能共同决定了其折叠成稳定的后向K-turn结构。
研究团队通过分析保守的bktRNA1基因二级结构的共进化和SHAPE信号值,发现它是一个由后向K-turn结构基序与box H/ACA snoRNA (SNORA12)构成的嵌合ncRNA分子 (图2)。在不同细胞类型中的亚细胞定位分析都发现bktRNA1主要存在于Cajal Body中。同时,通过删除和突变bktRNA1的后向K-turn结构发现后向K-turn结构基序对于bktRNA1的加工、成熟及稳定存在是必不可少的。

图2 进化保守的bktRNA1的二级结构及其折叠特征信号
为了研究这些bktRNA在体内可能靶向哪些RNA而发挥调控功能,研究团队通过15.5K蛋白的CLASH测序,发现进化保守bktRNA1在细胞内与minor splicesome(次要剪接体)中的U12 snRNA形成14个碱基的互补配对。分析RNA-RNA互作的PARIS测序数据也证明bktRNA1与U12 snRNA形成这个长互补配对。由于U12上的配对区域具有2'-O-甲基化修饰(2'-O-Me)且配对区毗邻一个类似K-turn的结构(K-turn like),因此猜想bktRNA1可能指导2'-O-甲基转移酶FBL催化U12的2'-O-甲基化修饰。为了验证这个猜想,研究团队使用FBL蛋白的CLASH测序进一步证实bktRNA1与U12 snRNA形成长的完全互补配对。并通过开发基于荧光标记的引物延伸技术(irPE)及利用CRISPR/Cas9敲除技术和回复实验等手段,证实了bktRNA1及其后向K-turn结构基序对于介导U12 snRNA的第八位腺嘌呤核苷酸(Am8)的2'-O-甲基化修饰是必不可少的。
研究团队进一步通过对四组删除不同区域的bktRNA1-KO细胞进行RNA-seq测序及剪接分析,发现敲除bktRNA1影响超过75%的U12型内含子剪接。进一步通过qPCR和RT-PCR及回复实验证实了bktRNA1及U12上的2'-O-甲基化修饰决定了U12 型剪接的保真度。通过Northern Blot、ChIRP、RNA pull-down和RNA EMSA等实验手段对次要剪接体及U12 snRNA进行分析发现bktRNA1的缺失导致ZCRB1不能结合到次要剪接体。同时,对敲低ZCRB1的细胞进行测序和细胞表型分析发现bktRNA1与ZCRB1对U12内含子剪接及细胞表型影响都是一致的。这些结果表明由bktRNA1介导的U12 上2'-O-甲基化修饰对于将ZCRB1募集到 U11–U12 di-snRNP复合体以及U12型内含子的剪接是必须的。
为了研究其他bktRNA在RNA剪接加工的作用,研究团队基于GFP内含子报告载体研究了多个突变后向K-turn结构基序的bktRNA,发现基序突变会影响超过80%随机选择的bktRNA所在内含子的剪接加工(local intron splicing,局部内含子剪接)。进一步通过利用Prime Editing技术也证实在体内突变后向K-turn结构基序会影响与15.5K蛋白的结合和局部内含子剪接。这些结果表明bktRNA是依赖于后向K-turn结构基序调控局部内含子剪接。
综上所述,这项研究工作通过开发多种新实验方法和计算机算法发现了在固定位置具有后向K-turn结构和序列基序的新类型bktRNA,揭示了由bktRNA、RNA甲基化和RNA剪接体的相互作用(crosstalk)形成的新层次基因表达调控机制(图3)。这项工作将为发现其他bktRNA/ncRNA及剖析它们在细胞和疾病中的功能机制研究打开了大门和提供全新的解决方案。
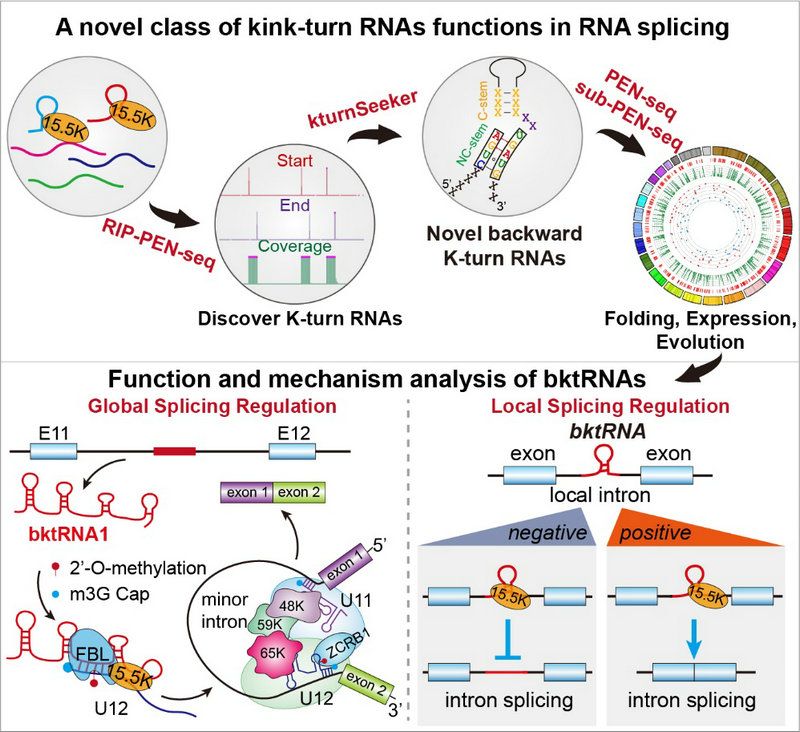
图3 bktRNA的系统鉴定及功能机制研究
近日,该研究以“RIP-PEN-seq identifies a class of kink-turn RNAs as splicing regulators”为题在Nature Biotechnology上发表。中山大学生命科学学院为第一作者单位。本工作受到科技部重点研发项目、国家自然科学基金项目资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


