Science:重大突破!揭示蛋白凝集相变调节SOS介导的Ras活化
来源:本站原创 2019-04-14 14:17
2019年4月14日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学伯克利分校的研究人员有史以来第一次对单个免疫系统分子因响应环境信号而被激活的过程进行成像观察,从而获得了一项关键发现:这种激活过程涉及数百种蛋白通过一种称为相变的过程突然聚集在一起而形成一种连接网络。相关研究结果发表在2019年3月8日的Science期刊上,论文标题为“A molecular assembly ph
2019年4月14日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学伯克利分校的研究人员有史以来第一次对单个免疫系统分子因响应环境信号而被激活的过程进行成像观察,从而获得了一项关键发现:这种激活过程涉及数百种蛋白通过一种称为相变的过程突然聚集在一起而形成一种连接网络。相关研究结果发表在2019年3月8日的Science期刊上,论文标题为“A molecular assembly phase transition and kinetic proofreading modulate Ras activation by SOS”。
这一发现表明我们在理解免疫系统经精细调整后如何在数以百万个其他分子中检测哪怕单个病毒分子从而允许我们快速地从流感病毒等病毒感染中康复过来的目标上取得巨大的飞跃。通过了解这些特定蛋白的作用机制,科学家们将能够更好地掌握为何它们的活性有时出现差错---能够导致诸如糖尿病和类风湿性关节炎之类的自身免疫疾病的事件---并且可能对如何指导患者自身的免疫系统来治愈癌症提供新的独特见解。
论文通讯作者、美国能源部劳伦斯伯克利国家实验室化学家Jay Groves说道,“这是在细胞作出决策的过程中在活细胞内部发生的事情---我们称之为信号转导,这是细胞通过化学反应进行‘思考’的方式。在整个生物学领域,蛋白凝集相变(protein condensation phase transition)的观点近期引起了很多关注。世界各地的许多团体都在研究这些现象,但是在此之前,没有人知道细胞如何或为何使用它们。”
Groves说,“我相信,我们的论文是第一篇直接测试和证实相变如何调节信号转导的论文。一项最大的发现是它是一种分子计时机制。细胞利用时间将真正的受体刺激与背景化学噪声区分开来。”
研究一种至关重要的细胞信使
这一发现是Groves实验室在对T细胞信号转导和Ras蛋白的物理机制进行研究时取得的。Ras在所有真核细胞中存在多种变体,并且扮演着多种角色,包括调节细胞生长、分裂和死亡。作为一类检测外来和潜在有害感染的免疫系统细胞,T细胞使用Ras作为发起保护性反应的入侵者报警通道的分子开关。T细胞区分真正外来信号---当外来分子与细胞表面上的T细胞受体(TCR)结合时---和无意中与邻近蛋白接触的能力对功能正常的免疫系统至关重要。如果T细胞意外地与我们自身的一种分子发生反应,那么自身免疫疾病就会产生。与此同时,如果T细胞失去它的敏感性,那么病毒将能够不受控制地生长,癌细胞将不会从体内清除。
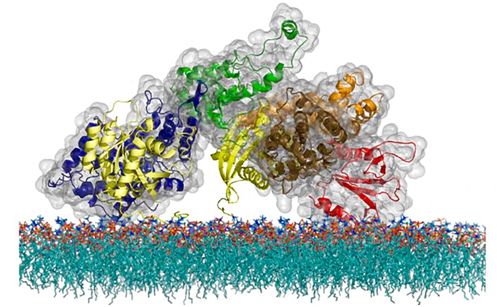
由于对人类健康的广泛影响,科学家们一直想知道T细胞如何调节它们的信号来实现这种平衡。过去的研究已表明T细胞的Ras蛋白不会直接与细胞受体相互作用。相反,受体将“开启”信号发送到细胞内部的中间蛋白,包括三种关键的蛋白(LAT、Grb2和SOS),最终将这种信号传递给Ras。在这项研究之前,科学家们已知道这三种蛋白能够在相变过程中连接在一起,但是没有人知道相变所发挥的作用。直到最近,人们才有可能弄明白,这是因为在此之前没有技术可以让科学家们直接监测复杂细胞膜系统中各个分子的活动。
Groves及其团队通过发明一种基于支持膜微阵列(supported membrane microarray)的方法消除了这一障碍。这种技术是该团队多年来一直在开发的技术,它使用由纳米制造结构制成的支架来固定细胞膜。
相变在起作用
在这项新的研究中,Groves团队使用显微镜来观察支持膜微阵列上的T细胞受体请求单个SOS分子活化的时刻。SOS不会立即响应,而是等待10~30秒才进入活性状态。如果邻近的LAT和Grb2分子与SOS经历相变,并凝聚成它们的组装状态,那么它们就能够让SOS在膜上保持足够长的时间以便SOS活化。如果没有发生相变,那么SOS分子的长时间延迟会阻止它在离开T细胞受体之前活化。
Groves解释道,“这就像这种蛋白内含延迟一样。它需要相变与持续性信号相结合,然后它才会活化。”
尽管这项研究是针对T细胞信号转导的,但是Groves及其同事们认为类似的相变计时机制可能参与多种其他的细胞反应。鉴于该团队建立了一种经过验证的实验技术来观察这些过程的分子活化,他们希望能够解开更多关于细胞如何执行如此多复杂任务的长期谜团。(生物谷 Bioon.com)
参考资料:
William Y. C. Huang et al. A molecular assembly phase transition and kinetic proofreading modulate Ras activation by SOS. Science, 2019, doi:10.1126/science.aau5721.
Erik W. Martin et al.Dwelling at membranes promotes decisive signaling. Science, 2019, doi:10.1126/science.aaw6434.

图片来自Steven Alvarez/Berkeley Lab。
这一发现表明我们在理解免疫系统经精细调整后如何在数以百万个其他分子中检测哪怕单个病毒分子从而允许我们快速地从流感病毒等病毒感染中康复过来的目标上取得巨大的飞跃。通过了解这些特定蛋白的作用机制,科学家们将能够更好地掌握为何它们的活性有时出现差错---能够导致诸如糖尿病和类风湿性关节炎之类的自身免疫疾病的事件---并且可能对如何指导患者自身的免疫系统来治愈癌症提供新的独特见解。
论文通讯作者、美国能源部劳伦斯伯克利国家实验室化学家Jay Groves说道,“这是在细胞作出决策的过程中在活细胞内部发生的事情---我们称之为信号转导,这是细胞通过化学反应进行‘思考’的方式。在整个生物学领域,蛋白凝集相变(protein condensation phase transition)的观点近期引起了很多关注。世界各地的许多团体都在研究这些现象,但是在此之前,没有人知道细胞如何或为何使用它们。”
Groves说,“我相信,我们的论文是第一篇直接测试和证实相变如何调节信号转导的论文。一项最大的发现是它是一种分子计时机制。细胞利用时间将真正的受体刺激与背景化学噪声区分开来。”
研究一种至关重要的细胞信使
这一发现是Groves实验室在对T细胞信号转导和Ras蛋白的物理机制进行研究时取得的。Ras在所有真核细胞中存在多种变体,并且扮演着多种角色,包括调节细胞生长、分裂和死亡。作为一类检测外来和潜在有害感染的免疫系统细胞,T细胞使用Ras作为发起保护性反应的入侵者报警通道的分子开关。T细胞区分真正外来信号---当外来分子与细胞表面上的T细胞受体(TCR)结合时---和无意中与邻近蛋白接触的能力对功能正常的免疫系统至关重要。如果T细胞意外地与我们自身的一种分子发生反应,那么自身免疫疾病就会产生。与此同时,如果T细胞失去它的敏感性,那么病毒将能够不受控制地生长,癌细胞将不会从体内清除。
由于对人类健康的广泛影响,科学家们一直想知道T细胞如何调节它们的信号来实现这种平衡。过去的研究已表明T细胞的Ras蛋白不会直接与细胞受体相互作用。相反,受体将“开启”信号发送到细胞内部的中间蛋白,包括三种关键的蛋白(LAT、Grb2和SOS),最终将这种信号传递给Ras。在这项研究之前,科学家们已知道这三种蛋白能够在相变过程中连接在一起,但是没有人知道相变所发挥的作用。直到最近,人们才有可能弄明白,这是因为在此之前没有技术可以让科学家们直接监测复杂细胞膜系统中各个分子的活动。
Groves及其团队通过发明一种基于支持膜微阵列(supported membrane microarray)的方法消除了这一障碍。这种技术是该团队多年来一直在开发的技术,它使用由纳米制造结构制成的支架来固定细胞膜。
相变在起作用
在这项新的研究中,Groves团队使用显微镜来观察支持膜微阵列上的T细胞受体请求单个SOS分子活化的时刻。SOS不会立即响应,而是等待10~30秒才进入活性状态。如果邻近的LAT和Grb2分子与SOS经历相变,并凝聚成它们的组装状态,那么它们就能够让SOS在膜上保持足够长的时间以便SOS活化。如果没有发生相变,那么SOS分子的长时间延迟会阻止它在离开T细胞受体之前活化。
Groves解释道,“这就像这种蛋白内含延迟一样。它需要相变与持续性信号相结合,然后它才会活化。”
尽管这项研究是针对T细胞信号转导的,但是Groves及其同事们认为类似的相变计时机制可能参与多种其他的细胞反应。鉴于该团队建立了一种经过验证的实验技术来观察这些过程的分子活化,他们希望能够解开更多关于细胞如何执行如此多复杂任务的长期谜团。(生物谷 Bioon.com)
参考资料:
William Y. C. Huang et al. A molecular assembly phase transition and kinetic proofreading modulate Ras activation by SOS. Science, 2019, doi:10.1126/science.aau5721.
Erik W. Martin et al.Dwelling at membranes promotes decisive signaling. Science, 2019, doi:10.1126/science.aaw6434.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


