Cell重磅:贺建奎基因编辑的抗艾滋病CCR5Δ32缺失的前世今生
来源:生物世界 2025-05-07 10:15
这项研究提醒我们:每个基因突变都是人类数百万年的进化史诗的结晶,而简单粗暴的“基因剪刀”可能剪断的是我们尚未理解的生存智慧。
1996 年 6 月,当时在纽约大学做博士后的邓宏魁在 Nature 期刊发表论文【1】,首次发现了 CCR5 基因(当时命名为 CC-CKR-5),并证实 CCR5 是 HIV-1 病毒入侵细胞的受体。2 个月后,布鲁塞尔自由大学的研究人员在 Nature 期刊发表论文【2】,证实了携带 CCR5delta32 等位基因纯合突变(CCR5delta32/delta32)的人对 HIV-1 感染具有抵抗力,这一 32 个碱基的缺失,导致 CCR5 基因转录提前终止,HIV-1 病毒无法入侵细胞,约 1% 的白种人携带这种纯合突变,他们天然能够抵抗艾滋病。
2007 年,一位名叫 Timothy Ray Brown 的艾滋病患者因患上了急性髓细胞白血病而接受了骨髓移植,这不仅治好了他的白血病,也让他体内的 HIV-1 病毒奇迹般地消失了,他也因此成为了地球上唯一一个被治愈的艾滋病患者,他就是大名鼎鼎的“柏林病人”。他之所以会被治愈,是因为给他捐献骨髓的人,携带了 CCR5delta32/delta32 纯合突变。此后,陆续有几位类似患者通过该方法实现了艾滋病的持续缓解,这让科学家们对以 CCR5 基因为突破口来治疗艾滋病充满希望。
2018 年 11 月,贺建奎宣布了“CRISPR Baby”的诞生,震惊了全世界,他宣称,通过 CRISPR-Cas9 基因编辑技术让人携带 CCR5delta32,从而获得对艾滋病的终身免疫能力。这一鲁莽且违背医学伦理的行为遭到了全世界科学家和民众的一致反对,此外,CCR5delta32 还与感染其他病毒、免疫相关疾病、神经障碍以及各类癌症在内的其他病理状况有关,因此,科学界对“CRISPR Baby”可能产生的临床副作用提出了严重关切。
这个能让人类抵抗艾滋病的基因突变究竟从何而来?为什么它在欧洲白人中相对常见,却从未在非洲和东亚原住民中出现?
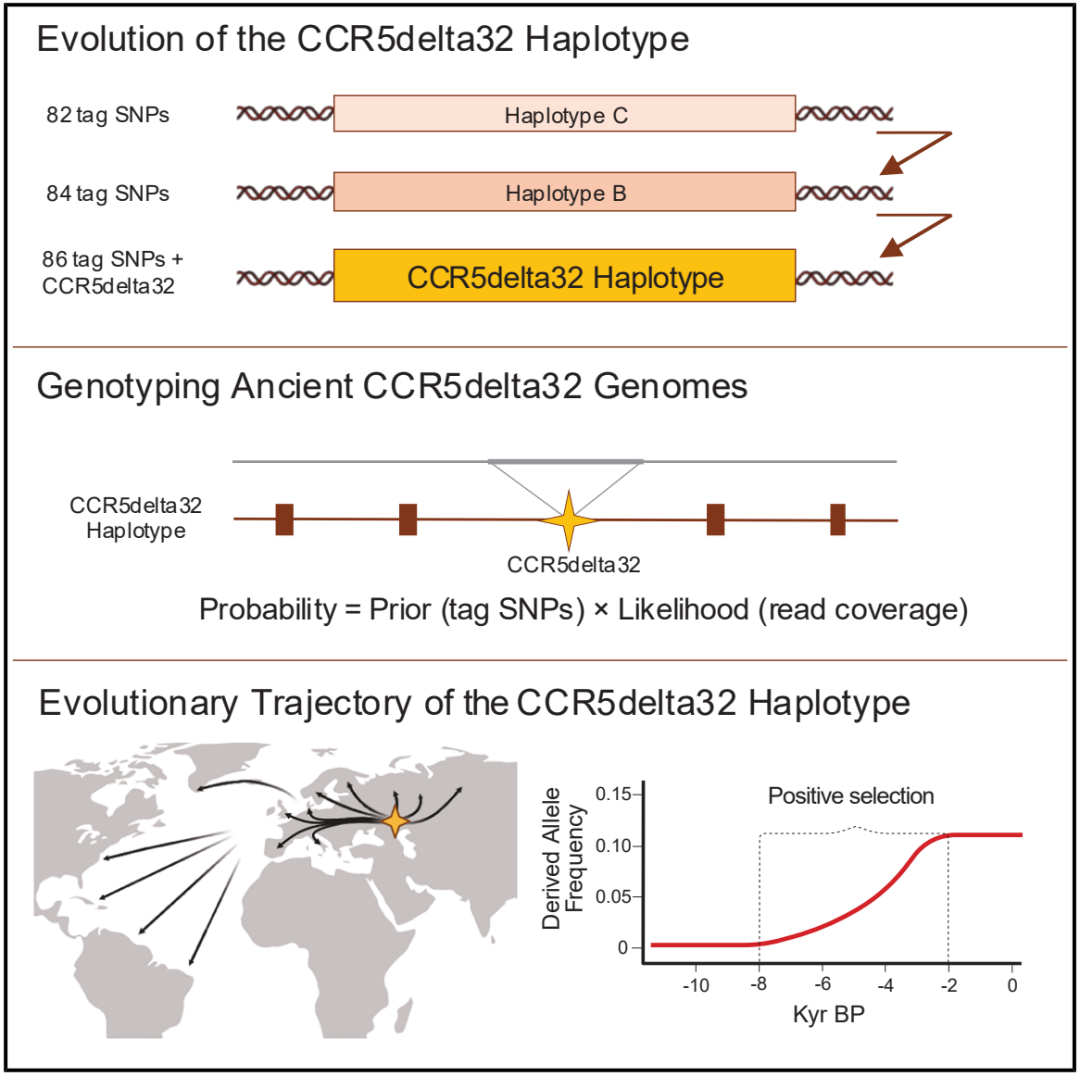
2025 年 5 月 5 日,哥本哈根大学的研究人员在国际顶尖学术期刊 Cell 上发表了题为:Tracing the evolutionary history of the CCR5delta32 deletion via ancient and modern genomes 的研究论文【3】。
该研究通过分析 934 具古代遗骸和 2504 个现代人类基因组,追踪了 CCR5delta32 缺失突变的演化轨迹,表明了 CCR5delta32(CCR5Δ32)缺失突变在 6700 多年前起源于西伯利亚草原游牧族群,此外,该等位基因在距今 8000 至 2000 年间经历了自然选择,后来通过大航海时代等历史事件传播到了拉丁美洲。这项研究首次全面描绘了 CCR5delta32 等位基因的演化历史。

CCR5delta32 是位于人类 3 号染色体上 CCR5 基因中的一段 32 个碱基的缺失突变。当人体携带两个该突变拷贝时,能够完全阻断 HIV-1 病毒入侵免疫细胞,从而免疫艾滋病,这一发现后来既帮助治愈了几名艾滋病患者,也引发了“CRISPR Baby”的伦理争议。
CCR5delta32 缺失的进化史一直备受争议,在北欧人群中,CCR5delta32 等位基因频率在 0.10-0.16 之间,而在南欧和东南欧则低于 0.08,在欧洲以外地区,这种缺失仅见于具有欧洲血统的人群中,它为何从未在非洲、东亚原住民中出现?此外,过去的研究对 CCR5delta32 等位基因出现的时间进行了估算,但结果差异很大,从约 700 年到约 3400 年,甚至超过 5000 年不等。这些结果都让科学们很是困惑。
传统观点认为,CCR5delta32 是千年的瘟疫选择的结果。而这项发表于 Cell 的研究颠覆了这一认知——通过分析 934 具古代遗骸和 2504 个现代人类基因组,哥本哈根大学的研究人员发现,它的起源比之前认为的要古老得多。
草原游牧民的基因遗产
为了追踪 CCR5delta32 等位基因随时间的演化,研究团队旨在识别携带该缺失的古代个体。为了实现这一目标,他们开发了一种针对插入缺失突变的单倍型感知概率模型(haplotype-aware probabilistic model for indels,HAPI),其能够在低覆盖度的古基因组中精准识别出 DNA 片段缺失。在俄罗斯南部草原 4700 年前的颜那亚人遗骸中,研究团队发现了最古老的确凿证据。基因溯源显示,这个缺失突变在约 6700 年前诞生于西伯利亚草原游牧族群。
更惊人的是,这个缺失突变并非“横空出世”,它诞生于一个包含 84 个突变的古老基因组合(Haplotype B),这个基因组合本身已存在上万年,而自然选择放大了携带这个缺失突变的个体的生存优势。
青铜时代的自然选择
通过模拟基因扩散模型,研究团队发现,CCR5delta32 缺失突变在距今 8000-2000 年前经历强烈正选择。这一时期恰逢欧亚大陆的青铜技术革命,人口流动加剧可能促进了某种病原体的传播。尽管具体选择压力尚未明确,但数据显示其频率在 2000 年前已趋于稳定,排除了中世纪时期黑死病作为主要驱动因素。
有趣的是,该缺失突变在现代拉丁美洲的出现完全源于大航海时代后的基因交流。而在非洲族群中发现的相似的基因片段,揭示了人类抗病基因库的复杂演化网络。
超越艾滋病的医学启示
这项研究不仅改写进化史教科书,更为医学研究敲响警钟:
1、CCR5delta32 缺失突变所在的整个基因组合与阿尔茨海默病、糖尿病等多种疾病相关;
2、基因编辑若仅靶向 CCR5delta32,可能会或略其他协同作用的遗传元件;
人体是一个复杂且精密的生态系统,任何“基因改造”都需要敬畏自然的复杂性。
此外,该研究也提示我们,古 DNA 技术为解析复杂疾病遗传机制开辟了新途径。未来,科学家可以继续追踪 CCR5delta32 在免疫系统中的多重角色,而它的古老起源或许还能为艾滋病之外的其他疾病治疗带来新启示。
从草原篝火到现代实验室,CCR5delta32 的演化故事见证着人类与病原体永不停息的军备竞赛。当我们在基因图谱中寻找治病钥匙时,这项研究提醒我们:每个基因突变都是人类数百万年的进化史诗的结晶,而简单粗暴的“基因剪刀”可能剪断的是我们尚未理解的生存智慧。
论文链接:
1. https://www.nature.com/articles/381661a0
2. https://www.nature.com/articles/382722a0
3. https://www.cell.com/cell/fulltext/S0092-8674(25)00417-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


