Cell Reports: Chk1保护致癌KRAS表达细胞免受DNA损伤,是胰腺癌治疗的靶点
来源:本站原创 2021-12-14 13:37
胰腺导管腺癌(PDAC)是美国癌症相关死亡的第三大原因,5年生存率令人沮丧,仅为10%。尽管PDAC有明确的遗传图景,但到目前为止还没有开发出临床有效的靶向治疗方法,目前的治疗标准仍然是常规的细胞毒药物。
胰腺导管腺癌(PDAC)是美国癌症相关死亡的第三大原因,5年生存率令人沮丧,仅为10%。尽管PDAC有明确的遗传图景,但到目前为止还没有开发出临床有效的靶向治疗方法,目前的治疗标准仍然是常规的细胞毒药物。KRAS癌基因的突变发生在>95%的病例中,突变的KRAS在推动PDAC生长中的作用已经得到了很好的证实。尽管在临床开发一种KRAS突变的直接抑制物(G12C)方面取得了进展,但该突变仅占PDAC中KRAS突变的2%.
KRAS效应信号网络的抑制剂是针对突变的KRAS功能用于癌症治疗的最有前途的间接策略。在众多下游效应因子中,RAF-MEK-ERK丝裂原活化蛋白激酶(MAPK)级联通路是阻断KRAS致癌活性最受追捧的靶点之一。
图片来源: https://doi.org/10.1016/j.celrep.2021.110060
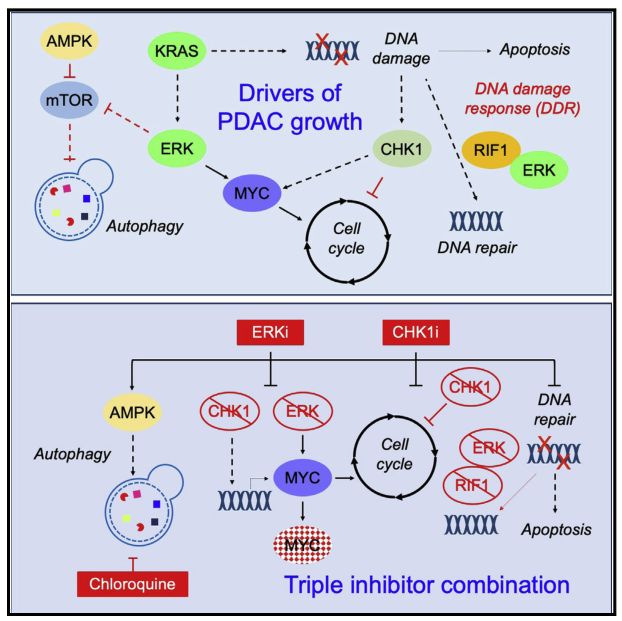
RAF-MEK-ERK信号网络是KRAS依赖的肿瘤生长的驱动因素,抑制ERK是治疗KRAS突变PDAC的有效方法。然而,治疗诱导的癌细胞获得性耐药和正常的细胞毒性限制了ERK抑制剂的有效性。
为了克服这些限制,我们应用功能筛选来确定增强Erki疗效的组合。我们确定CHK1功能的丧失增强了Erki介导的对KRAS突变型PDAC细胞系和类有机物的生长抑制。我们发现多种机制参与了这一结合,其中之一是对Rif1介导的NHEJ修复和RAD51介导的HRR的双重阻断,其中之一是对Rif1介导的NHEJ修复和RAD51介导的HRR的双重阻断。
此外,我们还发现CHK1i激活了AMPK并刺激了自噬,同时抑制CHK1和自噬也导致了生长抑制。最后,CHK1、ERK和自噬抑制剂的三重组合造成了进一步的生长抑制。综上所述,虽然抑制CHK1已被考虑用于导致DNA损伤的治疗,但我们的发现也支持将CHK1抑制剂与KRAS效应信号和自噬抑制剂一起使用。
我们发现CHK1i是一种增强ERK抑制剂治疗抗肿瘤活性的策略,这与之前对非PDAC癌症的研究不同,在非PDAC癌症中,ERK MAPK信号与CHK1i敏感性有关,而MEK抑制导致CHK1i耐药。然而,我们的发现与多发性骨髓瘤的研究是一致的,在多发性骨髓瘤的研究中,同时抑制mek和chk1会在体内外引起协同生长抑制。
ERKI和CHK1i组合在PDAC中疗效的一个机制基础是CHK1函数的收敛。我们发现Erki抑制CHEK1基因转录,补充CHK1催化功能的抑制。这一机制证实了先前的观察结果,即MEK1/2抑制放射增敏的PDAC细胞,并导致NHEJ和HRR蛋白的抑制。这种协同作用的第二个机制基础可能涉及ERK介导的糖酵解抑制。我们和其他人之前证明了ERK-MEK的抑制导致糖酵解的下调。
我们还确认AMPK的激活和自噬的诱导是对CHK1i治疗的反应。CHK1i是如何导致AMPK激活的尚不清楚。然而,与我们最近发现的ERK抑制类似,我们观察到CHK1抑制增加了自噬通量,并使KRAS突变PDAC细胞敏化以抑制自噬。我们的结果支持并推广了自噬抑制剂CQ抑制溶酶体使PDAC细胞对复制应激反应的抑制剂敏感的观察结果。
Chk1保护致癌KRAS表达细胞免受DNA损伤,是胰腺癌治疗的靶点
图片来源: https://doi.org/10.1016/j.celrep.2021.110060
综上所述,致癌的KRAS驱动的PDAC细胞生长对调控细胞周期、DDR和大分子代谢的重要基因的丢失非常敏感。通过对CHK1i诱导的信号变化的剖析,我们确定了可以作为PDAC联合抑制剂治疗靶点的关键信号节点。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



