Nature Methods:当细胞开始“自白”,解码癌症基因的双面叙
来源:生物探索 2025-02-19 11:56
DEFND-seq能够同时分析同一细胞核的DNA和RNA,研究人员能直接建立基因突变-表达表型-细胞功能的因果关系,为精准医疗提供全新工具。
在肿瘤的微观宇宙中,每个癌细胞都像是携带双重身份的特工:它的DNA中潜藏着驱动恶性行为的突变密码,而RNA则实时演绎着这些指令带来的致命行动。然而,研究人员长久以来被迫以“分屏视角”观察这场阴谋——单细胞RNA测序(scRNA-seq)揭示细胞的行为特征,单细胞DNA测序(scDNA-seq)捕捉基因组的异常,但二者如同断线的密码本,难以拼凑出完整的犯罪证据链。这种割裂在胶质母细胞瘤(glioblastoma)等高度异质性肿瘤中尤为致命:为何某些携带EGFR基因扩增的细胞疯狂增殖,而另一些PDGFRA突变的细胞却伪装成神经前体细胞逃避免疫追杀?传统技术无法回答的问题,正在成为精准医疗的“黑洞”。
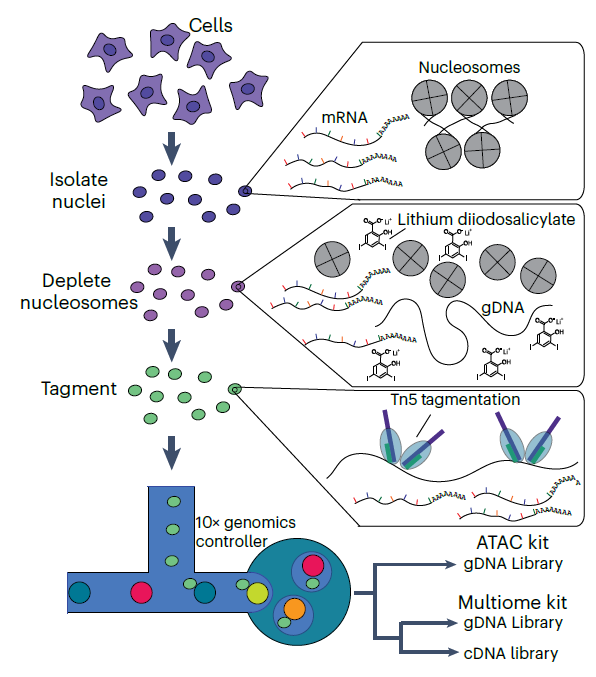
2月12日《Nature Methods》的一项突破性研究“Scalable co-sequencing of RNA and DNA from individual nuclei”带来了颠覆性工具——DEFND-seq(DNA和表达谱联合测序技术)。这项技术如同给细胞核安装“双通道监听器”,首次实现从同一细胞核中同步捕获全基因组DNA变异和全转录组RNA表达。其核心创新在于锂二碘水杨酸(lithium diiodosalicylate)介导的染色质解聚技术:通过温和去除核小体(nucleosome),让DNA舒展成可被转座酶(transposase)均匀切割的“开放书页”,同时保留核膜完整性以捕获完整RNA。结合10x Genomics微流控系统,单个实验即可分析数万个细胞核,每个细胞的试剂成本仅0.56美元,却可检测超过73万条DNA片段和2万个RNA分子,灵敏度与性价比远超同类技术。
在胶质母细胞瘤的实战中,DEFND-seq揭开了令人震撼的真相:携带EGFR扩增(DNA拷贝数变异)的细胞群高表达细胞周期基因TOP2A,而PDGFRA突变的亚克隆则呈现少突胶质前体细胞(OPC-like)的转录特征。更惊人的是,在看似均质的肿瘤中,某些稀有细胞竟同时拥有EGFR p.D1082N和MAP2K3 p.D24N突变,提示它们可能是耐药性的“种子选手”。这些发现不仅验证了技术可靠性,更凸显其揭示“基因突变-细胞行为-临床表型”因果链的独特价值。
更值得关注的是,DEFND-seq成功唤醒了沉睡多年的冷冻肿瘤样本。在对保存4年的胶质母细胞瘤分析中,研究人员仍捕获到MYCN基因扩增和PTEN缺失的致癌特征,这为利用海量临床库存样本开展回溯性研究打开闸门。这项技术像一台时间机器,让我们能重新聆听那些曾被冰封的细胞故事。从癌症进化图谱到发育生物学谱系追踪,DEFND-seq正为生命科学提供前所未有的“全息视角”,而它的故事,才刚刚开始书写。

为什么我们需要同时读取DNA和RNA?肿瘤的“双重伪装术”
癌症的致命之处在于其高度的异质性——同一肿瘤中,不同癌细胞可能携带不同的基因突变(DNA层面),同时表现出截然不同的行为模式(RNA层面)。例如,某些胶质母细胞瘤(glioblastoma)细胞可能因EGFR基因扩增而疯狂增殖,另一些则因PDGFRA突变获得侵袭能力。传统单细胞测序技术如scRNA-seq(单细胞RNA测序)或scDNA-seq(单细胞DNA测序)只能揭示其中一面,导致两个关键问题:
基因突变如何驱动特定细胞行为?例如,某个DNA拷贝数变异(CNV)是否直接导致下游基因表达异常?
肿瘤微环境中,癌细胞如何与正常细胞互动?这些互动是否受特定突变调控?
DEFND-seq的诞生,正是为了解开这些谜题。通过同时分析同一细胞核的DNA和RNA,研究人员能直接建立基因突变-表达表型-细胞功能的因果关系,为精准医疗提供全新工具。
DEFND-seq核心技术:如何让DNA和RNA“双剑合璧”?
DEFND-seq的全称是DNA和表达谱联合测序技术(DNA and Expression Following Nucleosome Depletion Sequencing),其核心创新在于两步关键操作:
1. 染色质解聚:打开细胞核的“折叠藏书”
细胞核中的DNA并非散乱分布,而是像紧密缠绕的线团,包裹在组蛋白(nucleosome)形成的染色质结构中。DEFND-seq使用碘化锂(lithium diiodosalicylate)处理细胞核,温和去除组蛋白,使DNA充分暴露。这种处理既保持核膜完整,又让后续的转座酶(transposase)能均匀切割DNA,避免传统方法因染色质压缩导致的数据偏差。
2. 微流控“分装术”:万级细胞的高通量捕获
解聚后的细胞核通过10x Genomics微流控芯片,与携带条形码(barcode)的磁珠共包裹在油滴中。每个油滴内,RNA被逆转录为带条形码的cDNA,DNA则被片段化并标记相同条形码。最终,通过测序可追溯每个DNA片段和RNA分子来自哪个细胞核,实现DNA突变与RNA表达的精准配对。
模式图(Credit: Nature Methods)
数据说话:DEFND-seq的四大性能突破
研究团队通过多组实验验证了DEFND-seq的可靠性,关键数据如下:
高覆盖度:捕捉更多基因“信号”
在人类BJ成纤维细胞中,DEFND-seq平均每个细胞核检测到731,814条独特DNA片段和20,000个独特RNA转录本,远超同类技术sci-L3(仅40,681条DNA片段和194个RNA)。
基因组覆盖均匀性(CV值)低至0.6(100 kb区间),媲美主流单细胞DNA测序技术(如LIANTI、PTA等)。
高准确性:区分“人类”与“小鼠”细胞的火眼金睛
在混合人类U87和小鼠3T3细胞的实验中,DEFND-seq仅产生5.2%的交叉污染,且RNA与DNA数据高度一致。例如,某个细胞若在RNA中显示90%人类基因表达,其DNA数据也会同步显示人类基因组特征,验证了技术的精准性。
冷冻样本兼容性:解锁临床珍贵样本
对保存4年以上的胶质母细胞瘤冷冻样本,DEFND-seq仍成功捕获1,821个细胞核,检测到关键致癌基因MYCN扩增和PTEN缺失。这意味着该技术可回溯分析大量临床库存样本,极大拓展研究资源。
成本可控:单个细胞分析仅需0.56美元
利用10x Genomics商业化平台,单次实验可处理超40,000个细胞核,每个细胞的试剂成本低至0.56美元(约合人民币4元),为大规模研究铺平道路。
实战案例:胶质母细胞瘤的“基因-表型”地图
胶质母细胞瘤(GBM)是最致命的脑癌,5年生存率不足5%。应用DEFND-seq分析患者肿瘤组织,研究者揭示了前所未有的细节:
发现“基因型-表型”强关联
EGFR扩增(DNA层面)的细胞群高表达增殖相关基因(如TOP2A),而PDGFRA扩增的细胞则呈现类似少突胶质前体细胞(OPC-like)的转录特征。
在DNA拷贝数聚类中,MDM2基因扩增普遍存在于所有癌细胞,提示其可能是驱动基因组不稳定的关键因素。
追踪稀有突变亚群
发现EGFR p.D1082N和MAP2K3 p.D24N等罕见体细胞突变,变异等位基因频率(VAF)低至5%-8%。这些突变可能介导肿瘤耐药性,成为潜在治疗靶点。
通过多平台测序(Illumina vs. Element Aviti)交叉验证,确认PREX1 p.T1469M突变在部分细胞中富集,且与星形细胞样表型相关。
技术优势:为何DEFND-seq是游戏规则改变者?
“一站式”分析平台:无需改造设备,直接兼容10x Genomics商业化系统,全球实验室可快速部署。
冷冻样本复活术:突破传统单细胞测序对新鲜样本的依赖,让历史临床数据焕发新生。
多组学扩展潜力:未来可与CRISPR筛选、谱系追踪等技术结合,解析基因调控网络。
成本效益比:相较于动辄数万美元的单细胞多组学方案,DEFND-seq将成本降低一个数量级。
未来:从实验室到临床的转化之路
DEFND-seq的应用远不止于癌症:
发育生物学:追踪胚胎早期细胞的基因突变与分化路径。
神经退行性疾病:揭示神经元DNA损伤与蛋白质异常表达的关系。
免疫治疗:筛选具有特定突变特征的T细胞克隆,优化CAR-T疗法。
这项技术就像给每个细胞核安装了“行车记录仪”,让我们能回放基因突变如何一步步改写细胞命运。
打开精准医学的“上帝视角”
DEFND-seq的诞生,标志着单细胞多组学分析迈入新时代。当研究人员能同时窥见细胞的“基因蓝图”和“行为日志”,癌症异质性、耐药机制、转移规律等难题将加速破解。或许在不远的未来,每个患者的肿瘤都将被解构为一张动态的“基因-表型地图”,指引真正个性化的治疗方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


