2024年7月Science期刊精华
来源:生物谷原创 2024-07-31 10:25
哺乳动物动物卵母细胞的较小染色体为何容易发生分离错误?这篇论文告诉你答案、新研究发现在母鼠与幼鼠互动时,幼鼠大脑未定区中的神经元变得更加活跃
2024年7月份即将结束,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1. Science:哺乳动物动物卵母细胞的较小染色体为何容易发生分离错误?这篇论文告诉你答案
doi:10.1126/science.adn5529
卵母细胞减数分裂过程中的染色体分离错误会导致卵子非整倍体(aneuploidy)。这种错误发生的频率随着母体年龄的增加而增加。体细胞中较大的染色体更容易发生分离错误,而衰老的卵母细胞则不同,它更倾向于在较小的染色体上发生分离错误。卵子中较小染色体非整倍体是导致流产和先天性疾病(如唐氏综合征)的主要原因。较小的染色体是如何在衰老的卵母细胞中优先发生分离错误的,目前尚不清楚。
在一项新的研究中,为了研究单个染色体的动态变化,来自日本理化学研究所生物系统动力学研究中心的研究人员开发了一套全面的荧光探针,可特异性标记小鼠 20 条染色体(19 条常染色体和一条X 染色体)中的每一条。利用这些探针,他们建立了一个实时成像管道,可在小鼠卵母细胞减数分裂过程中对已识别的染色体进行完整的三维跟踪。通过这一“染色体识别与跟踪(chromosome identifying-and-tracking)”管道,他们从 93 个卵母细胞中获取了九条不同的已识别染色体及其着丝粒的 217 条完整的三维轨迹。利用这一全面的数据集,他们旨在定量分析基于染色体大小的时空动态,并检验它们是否会导致较小染色体的优先分离错误。相关研究结果发表在2024年7月19日的Science期刊上,论文标题为“Live chromosome identifying and tracking reveals size-based spatial pathway of meiotic errors in oocytes”。
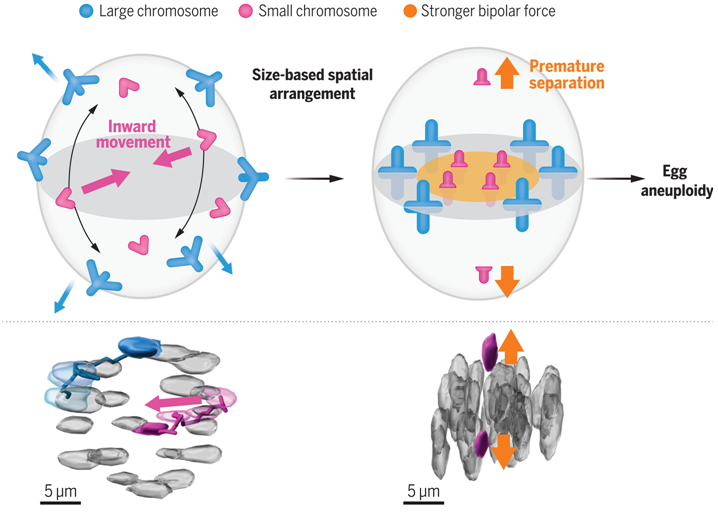
导致减数分裂错误的空间途径
图片来自Science, 2024, doi:10.1126/science.adn5529
他们的定量分析发现,尽管每条染色体在卵母细胞中的动态表现出很大的差异性,但较小的染色体在减数分裂的前中期(prometaphase)更倾向于向纺锤体赤道的内部区域移动。在小鼠和人类卵母细胞中,对较小染色体的这种偏好导致建立了一种基于染色体大小的空间排列,即较小染色体优先位于中期板(metaphase plate)的内侧区域。卵母细胞可以建立这种基于染色体大小的空间排列,而不需要预先存在染色体定位偏差,这表明存在一种主动建立这种空间排列的前中期途径。这些作者发现,较小的染色体倾向于更早地伸展,而且这种伸展与较小染色体的向内运动结合得更紧密,这表明这种前中期途径涉及较小染色体上更早的双极微管附着。这种前中期途径的活跃与年龄无关。
对老龄小鼠卵母细胞的染色体追踪显示,染色体过早分离主要发生在中期板的内部区域,这是由于衰老导致染色体内聚力降低,也是造成分离错误的主要原因。染色体的过早分离取决于双极微管的拉力,而这些作者发现,在着丝粒-着丝点(kinetochore-centromere)距离增加的情况下,中期板内部区域中的双极微管拉力明显更强。用人造珠子防止较小染色体在内部定位,可显著抑制衰老的卵母细胞在较长的减数分裂中期过早发生染色体分离,这表明较小染色体优先在内部定位是衰老的卵母细胞发生分离错误的风险之一。
2. Science:新研究发现在母鼠与幼鼠互动时,幼鼠大脑未定区中的神经元变得更加活跃
doi:10.1126/science.adk7411
在一项新的研究中,来自耶鲁大学和索邦大学的研究人员将光纤探针(fiber-optic probe)植入小鼠幼崽的大脑中,以进一步了解在幼崽与其母体的早期社会互动过程中会发生什么,从而导致母子纽带的建立。他们发现当母鼠与幼鼠互动时,小鼠大脑的一部分会变得更加活跃。相关研究结果发表在2024年7月26日的Science期刊上,论文标题为“Neurons for infant social behaviors in the mouse zona incerta”。
先前的研究表明,许多动物的母亲和它们的后代之间建立了牢固的纽带---这种纽带促使母亲教后代如何生存,并保护它们不受伤害。它还促使后代将母亲视为生存的源泉。但是,人们对诱发这种纽带的大脑发生了什么知之甚少。在这项新的研究中,研究者确定了大脑的哪些部分参与了这种纽带,以及在这种纽带发生中这些大脑部分发生了什么变化。

图片来自Science, 2024, doi:10.1126/science.adk7411
研究者在先前研究---表明母亲和子女之间的联系可能起源于未定区(zona incerta),即位于丘脑下部的一小块灰质---的基础上开始了他们的研究。先前的研究表明,婴儿大脑中这个区域的神经元向大脑的其他部分发送信号,帮助调节生长。
为了进一步了解这种活动,研究者植入了光纤探针,以监测神经放电。他们还采集了大脑样本,发现未定区中的神经元能表达一种叫做生长抑素(somatostatin)的激素,已知这种激素能阻止皮质酮等其他激素的释放,从而调节多种身体机能。
研究者随后研究了在小鼠幼崽进行包括哺乳在内的各种活动时未定区的行为。他们发现,当幼崽接受母鼠哺乳时,大脑这一部分的神经元会变得更加活跃。当幼崽遇到其他哺乳母鼠时,这些神经元也会变得更加活跃,不过活跃程度没有那么高。
3. Science:新研究揭示表观遗传学如何影响哺乳动物记忆形成
doi:10.1126/science.adg9982
当我们形成新的记忆时,大脑会发生物理和功能上的变化,统称为“记忆痕迹(memory trace)”。记忆痕迹代表了特定活动模式和神经元的结构变化,这些变化发生在记忆形成和后来的回忆中。但是,大脑如何“决定”哪些神经元将参与记忆痕迹呢?现有研究表明神经元固有的兴奋性在其中发挥了作用,但目前公认的学习观点却忽视了对神经元本身的指挥中心——细胞核的研究。在细胞核中,似乎存在着另一个未被探索的层面:表观遗传学。
在特定有机体的每个细胞内,DNA 所编码的遗传物质都是相同的,但组成人体的各种细胞类型,如皮肤细胞、肾细胞或神经细胞,却各自表达着一组不同的基因。表观遗传学就是研究细胞如何在不改变 DNA 序列的情况下控制这些基因活性的机制。
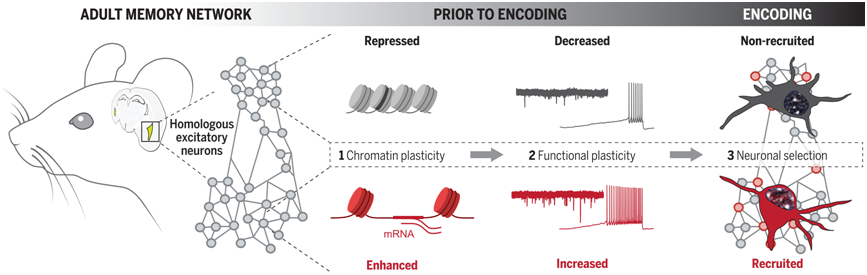
染色质可塑性有利于信息编码
图片来自Science, 2024, doi:10.1126/science.adg9982
如今,在一项新的研究中,洛桑联邦理工学院神经科学家Johannes Gräff及其团队探索了表观遗传学是否会影响神经元被选中形成记忆的可能性。他们的小鼠研究结果表明,神经元的表观遗传状态是它在记忆编码中发挥作用的关键。相关研究结果发表在2024年7月26日的Science期刊上,论文标题为“Chromatin plasticity predetermines neuronal eligibility for memory trace formation”。
Gräff和他的团队想知道表观遗传因素是否会影响神经元的“记忆”功能。当神经元细胞核内的DNA松散或松弛时,神经元在表观遗传学上是开放的;而当DNA紧凑紧密时,神经元在表观遗传学上是闭合的。Gräff说,“我们从以DNA为中心的层面揭示了记忆形成的最初步骤。”
他们发现,开放的神经元更有可能被招募到“记忆痕迹”中。“记忆痕迹”是大脑中神经元的稀疏集合,它们在学习新知识时会显示出电活动。事实上,处于更开放染色质状态的神经元也表现出更高的电活动。
随后,这些作者利用病毒递送表观遗传酶,从而人为诱导神经元的开放性。他们发现,相应的小鼠学习效果更好。当他们使用相反的方法闭合神经元的DNA时,这些小鼠的学习能力就被取消了。这些发现为理解神经元细胞核编码的学习开辟了新的途径,甚至有朝一日可能会开发出改善学习的药物。
4. Science:利用人类线粒体mRNA结构组揭示人类线粒体中的基因表达机制
doi:10.1126/science.adm9238
人类线粒体基因组(mtDNA)的表达为催化有氧能量转移并维持生命的氧化磷酸化(oxidative phosphorylation)酶复合物提供了 13 个重要的蛋白亚基。人类mtDNA 是一个 16.569Kb 的双链分子,有重链(H)和互补的轻链(L)。人类mtDNA的转录几乎横跨其整个长度,产生两个长的多顺反子转录本(polycistronic transcript),这两个多顺反子转录本经过处理后产生 11 个成熟的 mRNA,此外仍有两个转录单位仍未经过处理,以双顺反子元件形式存在,包含重叠的和-1 移位的开放阅读框(ORF),用以编码 ATP8 和 ATP6 或 ND4L 和 ND4。人类mtDNA还编码线粒体核糖体中合成这些蛋白所需的两种核糖体 RNA(12S rRNA和 16S rRNA)和 22 种转移 RNA(tRNA)。在过去的五十年中,有关 mtDNA 转录和线粒体信使 RNA(mt-mRNA)稳定性、加工、修饰和翻译的分子机制已逐渐被描述出来,并且仍然是研究的热点。然而,科学家们对 mt-mRNA 折叠结构组(structurome)的了解非常有限,这阻碍了人们对 mtDNA 基因表达及其调控的机理了解。
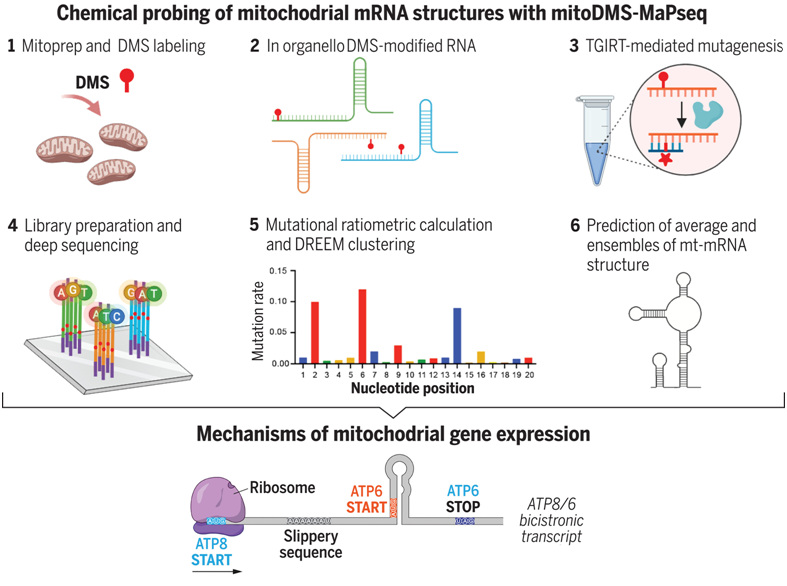
人类线粒体mRNA折叠图谱揭示了基因表达的机制
图片来自Science, 2024, doi:10.1126/science.adm9238
获取完整线粒体内的 mRNA 结构数据对于了解其生物背景至关重要。为此,来自迈阿密大学和哈佛医学院的研究人员在一项新的研究中改进了一种利用硫酸二甲酯(DMS)对 mRNA 结构进行化学探测的方法,其中硫酸二甲酯可将腺嘌呤和胞嘧啶未配对且可触及的碱基配对面甲基化。线粒体硫酸二甲酯突变分析测序(mitochondrial DMS mutational profiling with sequencing, mitoDMS-MaPseq)是一种高通量、全基因组 RNA 结构探测策略,它利用了一种高保真、进行性的第二组反转录酶(thermostable group II reverse transcriptase, TGIRT),该酶可将 RNA 中的硫酸二甲酯修饰转化为互补 DNA 中的错配。然后将 DMS 反应信息用作基于热力学的 RNA 折叠算法的约束条件,从而获得高精度的二级结构模型。相关研究结果发表在2024年7月19日的Science期刊上,论文标题为“The human mitochondrial mRNA structurome reveals mechanisms of gene expression”。
他们的研究结果阐明了 LRPPRC作为一种保持酶(holdase)有助于维持 mt-mRNA 折叠和高效翻译。对野生型线粒体中mt-mRNA 结构的深入认识和代谢标记揭示了基因表达的潜在机制。它们包括 mRNA 编程的翻译暂停,以支持 COX1(一种具有多个跨膜结构域的疏水性蛋白)的合成,以及 mRNA 程序性核糖体和随后发生的终止-再起始事件以协调双顺反子ATP8/6 转录本中两个 ORF 的翻译。此外,通过使用聚类算法 DREEM(使用期望最大化方法检测 RNA 折叠结构),他们确定了每个转录本所采用的共存替代构象,从而捕捉到了 mt-mRNA 折叠在结构集合体中的动态性质。
5. Science:一种诱导胎儿血红蛋白表达的 WIZ 转录因子降解剂有望用于治疗镰状细胞病
doi:10.1126/science.adk6129
在一项新的研究中,来自诺华生物医学研究公司的研究人员发现了一种用于诱导胎儿血红蛋白表达的 WIZ 转录因子降解剂,并在动物模型中进行了测试。他们的发现为镰状细胞病(sickle cell disease)患者开发出了一种可能的治疗方法。相关研究结果发表在2024年7月5日的Science期刊上,论文标题为“A molecular glue degrader of the WIZ transcription factor for fetal hemoglobin induction”。

图片来自Science, 2024, doi:10.1126/science.adk6129
在这项新的研究中,这些作者投入了大量资源,寻找一种既能开启胎儿血红蛋白表达,又不会引起其他问题的药物。更具体地说,他们的任务是找到一种能与蛋白cereblon结合的化合物。他们最终找到了一种名为dWIZ-1的化合物,经过优化后发现,给动物模型服用这种药物后,胎儿血红蛋白水平从基线的17%提高到了45%。他们相信,这一水平将大大减轻人类的症状。
虽然还需要对这种化合物进行更多测试,以确保它不会产生任何负面影响,但是这些作者相信,他们已经找到了一种可以制成药丸的化合物,它将大大减轻镰状细胞病的症状。
6. Science:新研究揭示mIDH1抑制剂激活抗肿瘤免疫反应机制
doi:10.1126/science.adl6173
许多癌症,包括某些脑瘤、肝瘤和骨髓性白血病,都是由异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)突变引起的。阻断突变的IDH1(mutated IDH1, mIDH1)的药物最近已经上市,并有效地减缓了肿瘤的生长,但阻滞肿瘤生长的确切机制仍不清楚。
如今,在一项新的研究中,来自麻省总医院和布罗德研究所的研究人员对这些药物有了一个惊人的发现。他们发现,mIDH1 抑制剂会欺骗肿瘤细胞,让它们以为自己感染了病毒,从而导致免疫系统做出抗病毒反应。这种称为“病毒模仿(viral mimicry)”的机制依赖于古老病毒感染的遗迹,这些遗迹散布在基因组中,但通常不会表达蛋白。用 mIDH1 阻断剂进行治疗会发现这些遗迹,从而引发针对肿瘤细胞的免疫反应。相关研究结果发表在2024年7月12日的Science期刊上,论文标题为“Mutant IDH1 inhibition induces dsDNA sensing to activate tumor immunity”。
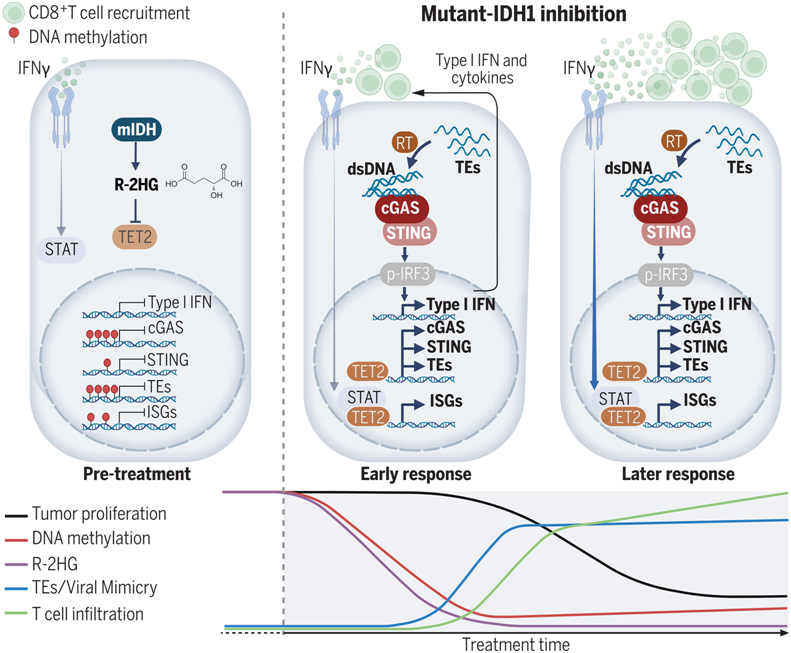
mIDH1抑制恢复免疫监视
图片来自Science, 2024, doi:10.1126/science.adl6173
在首次建立IDH1突变肝癌小鼠模型后,Bardeesy和他的同事们发现,只有免疫系统正常的小鼠才对mIDH1抑制剂有反应。为了了解其中的原因,Bardeesy实验室与论文共同通讯作者Robert Manguso以及论文共同第一作者Meng-Ju Wu、Hiroshi Kondo和Ashwin Kammula展开了合作。Manguso说,“这些发现揭示了一个完全出乎意料的、令人着迷的机制,解释了这类药物的功效。”
IDH1通常能促进称为去甲基化酶(demethylase)的酶的活性,这种酶能去除DNA上称为甲基基团的化学标签,使基因转录成RNA。但是mIDH1会产生一种叫做2-羟基戊二酸(2-hydroxyglutarate, 2HG)的代谢物,直接干扰去甲基化酶,从而导致肿瘤细胞主动抑制多个基因的表达。通过阻止 2HG 的产生,mIDH1 抑制剂可恢复去甲基化酶的活性,从而导致许多基因的重新表达,包括那些编码古老病毒酶的基因,这些基因可提醒免疫系统发动抗病毒反应。这种免疫反应依赖于一个名为 cGAS 的基因的表达,该基因能产生一种检测逆转录病毒的蛋白的一部分。在IDH1突变的细胞中,这个基因会因2HG的积累而沉默,但mIDH1抑制剂允许去甲基化酶促进cGAS的表达。
cGAS 可检测逆转录病毒,并启动一系列细胞事件,最终产生干扰素和其他细胞因子,引发抗病毒免疫反应。这表明沉默cGAS通路是IDH1突变肿瘤逃避免疫检测的一种方法。Wu说,“病毒模仿会触发免疫反应,并增强免疫细胞对癌细胞的杀伤力。这种机制可应用于具有类似代谢或表观遗传学改变的其他癌症。”
7. 揭开偏头痛之谜!Science:偏头痛先兆发作时,大脑释放的蛋白会随脑脊液流动,最终主要流向同一侧的感觉系统,引发疼痛信号神经
doi:10.1126/science.adl0544
在一项新的研究中,来自哥本哈根大学和罗切斯特大学医学中心的研究人员首次揭示了一种前所未见的机制,即大脑中的蛋白通过特定通道输送至一组特定的感觉神经,触发偏头痛发作。这一发现不仅为理解偏头痛的发病机理提供了重要线索,也为开发偏头痛及其它头痛类型的新疗法开辟了道路。相关研究结果发表在2024年7月5日的Science期刊上,论文标题为“Trigeminal ganglion neurons are directly activated by influx of CSF solutes in a migraine model”。
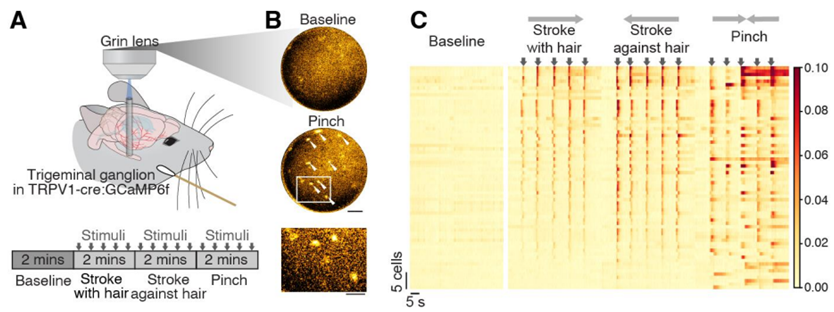
图片来自Science, 2024, doi:10.1126/science.adl0544
在本次研究中,研究人员在小鼠模型中首次发现,偏头痛先兆发作时,大脑释放的蛋白会随脑脊液流动,最终到达引发头痛的疼痛信号神经。论文第一作者、哥本哈根大学转化神经医学中心博士后Martin Rasmussen说,“我们发现,这些蛋白激活了颅骨底部的一组感觉神经细胞体(sensory nerve cell body),即所谓的三叉神经节(trigeminal ganglion),它是连接大脑与颅外周围感觉神经系统的桥梁。”
在三叉神经节的根部,通常缺失阻止物质进入外周神经的屏障,这使得脑脊液中的物质能够进入并激活疼痛信号感觉神经,从而导致头痛。论文通讯作者Maiken Nedergaard 教授说,“我们的研究揭示了大脑与外周感觉神经系统间的主要沟通渠道,这是一条对偏头痛产生至关重要的新信号通路,也可能与其他类型的头痛疾病相关。”
8. 罕见T细胞新发现!Science:科学家发现与人类免疫性障碍相关的罕见辅助T细胞类型,解锁免疫疾病治疗新途径
doi:10.1126/science.add8394
近日,一篇发表在国际杂志Science上题为“An atlas of transcribed enhancers across helper T cell diversity for decoding human diseases”的研究报告中,来自日本RIKEN综合医学科学中心等机构的科学家们通过研究发现了与人类免疫性障碍相关疾病,包括多发性硬化症、类风湿性关节炎、哮喘等的多种罕见辅助T细胞。
文章中,研究人员采用了一种新开发的名为ReapTEC的技术,其能在罕见的T细胞亚型中识别出与特定免疫障碍相关的基因增强子,这一开创性的T细胞图谱是公开发布的,有望加速开发治疗免疫介导人类疾病的新型药物疗法。
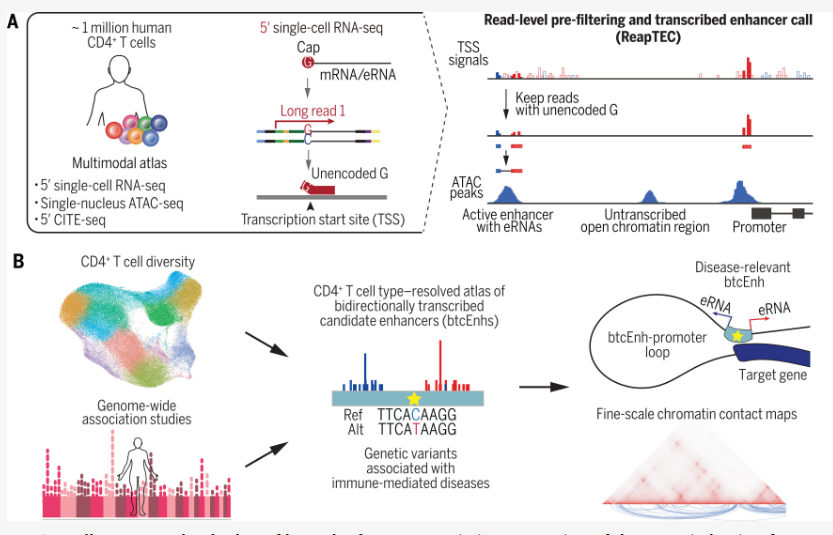
科学家发现与人类多种免疫障碍相关的新型T细胞和基因
图片来源:Science (2024). DOI:10.1126/science.add8394
在包括T细胞在内的所有细胞中都存在称之为“增强子”(enhancers)的DNA区域,它们不编码蛋白质,而是编码小片段RNA,以增强其他基因的表达。因此,T细胞增强子的变异可导致基因表达差异,进而影响T细胞功能。并且,一些增强子具有双向性,即两条DNA链均可作为增强子RNA的模板。
因此,研究人员通过联合研究开发了新型ReapTEC技术,旨在探索双向T细胞增强子与免疫疾病之间的联系。通过对约100万个人类T细胞的深入分析,研究者们鉴定了若干罕见T细胞类型,占比不足5%,并利用ReapTEC技术,识别出近6.3万个活性双向增强子。为了探究这些增强子是否与免疫疾病相关,研究者结合了全基因组关联性研究(GWAS)的数据,该研究揭示了与多种免疫疾病相关的遗传变异,即单核苷酸多态性(SNPs)。
当研究人员将GWAS数据与ReapTEC分析的结果相融合后发现,与免疫介导疾病相关的遗传突变,通常位于罕见T细胞的双向增强子DNA区域内,而神经系统疾病相关突变则不具备类似模式,表明这些罕见T细胞中的双向增强子可能特异性地与免疫介导疾病相关联。
通过进一步深入分析数据,研究人员发现,某些罕见T细胞中的单一增强子可能与特定免疫疾病直接相关。在6.3万个双向增强子中,研究者确认了606个增强子包含与18种免疫介导疾病相关的单核苷酸多态性。通过这一发现,研究者还识别了部分潜在的疾病相关增强子靶点基因,例如,激活包含与炎性肠病相关的遗传突变的增强子,产生的增强子RNA可诱导IL7R基因的上调。
9. Science:用于治疗抗生素耐药性的噬菌体通过破坏竞争对手的增殖能力而获得优势
doi:10.1126/science.adl1356
历史上,隐藏在各生命界基因组中的一些奇怪的DNA片段一直被忽视,因为它们似乎在生存竞争中没有发挥作用。这些 DNA 片段被称为“自私的遗传因子”,因为据科学家们所知,它们的存在只是为了增殖和传播自己,而不会给宿主生物带来任何好处。它们被视为基因搭便车者,无足轻重地代代相传。
在一项新的研究中,来自加州大学圣地亚哥分校的研究人员提供了新的证据,表明这些 DNA元件可能并不那么自私。相反,它们似乎在竞争生物之间的动态关系中起着相当重要的作用。相关研究结果发表在2024年7月5日的Science期刊上,论文标题为“An intron endonuclease facilitates interference competition between coinfecting viruses”。
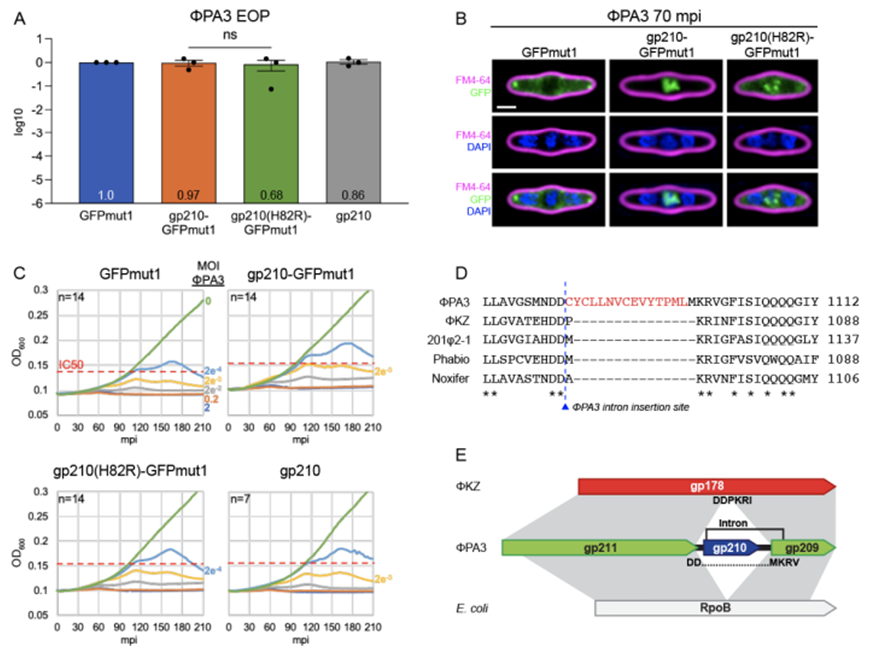
图片来自Science, 2024, doi:10.1126/science.adl1356
具体而言,他们研究了噬菌体中自私的遗传因子。他们吃惊地发现,称为“可移动内含子(mobile intron)”的自私遗传因子为病毒宿主在与其他病毒竞争时提供了明显的优势:噬菌体已将可移动内含子武器化,以破坏竞争噬菌体的增殖能力。
论文共同第一作者、加州大学圣地亚哥分校分子生物学系博士后学者Erica Birkholz说,“这是首次证实自私遗传因子能够为其入侵的宿主生物带来竞争优势。理解自私的遗传因子并不总是纯粹的‘自私’,对于更好地理解所有生命王国中的基因组进化具有广泛的意义。”
10. Science:新研究揭示转座子编码的内含子与向导RNA之间的拮抗冲突
doi:10.1126/science.adm8189
TnpB核酸酶是CRISPR-Cas12的进化前身,广泛存在于生命的各个领域,这可能是由于它们在转座子扩增中的关键作用。近期的研究已证实IS605 家族的 TnpB 同源物通过利用转座子编码的向导RNA——ωRNA,来切割基因组 DNA,因而通过 DNA 双链断裂刺激的同源重组来驱动转座子的维持,从而发挥可编程归巢内切酶的功能。这种途径在其他遗传环境中是否也是保守的,是否与其他转座酶有关联,目前还不得而知。
在一项新的研究中,来自哥伦比亚大学的研究人员重点研究了 IS607 家族转座子,这些转座子的转座生活方式鲜为人知,而且经常与 TnpB 和 ωRNA 一起编码自我剪接的 I 组内含子(group I introns)。相关研究结果发表在2024年7月12日的Science期刊上,论文标题为“Antagonistic conflict between transposon-encoded introns and guide RNAs”。
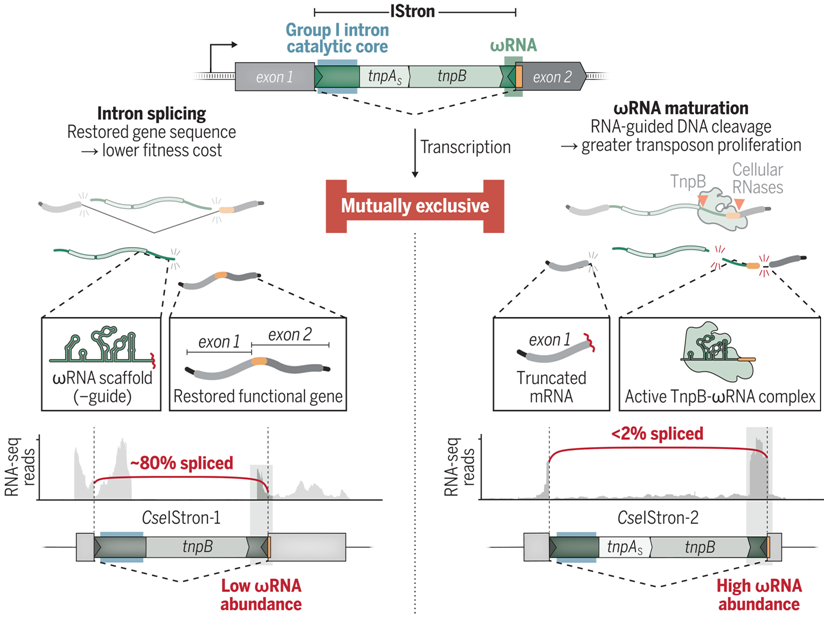
IStron编码的非编码RNA的冲突性质
图片来自Science, 2024, doi:10.1126/science.adm8189
IStron,即编码 I 组内含子的复合转座元件,具有必须被丝氨酸家族 TnpAS 转座酶忠实识别的边界序列,它们还编码催化性内含子 RNA 和与 TnpB 相关的 ωRNA。通过在 RNA 水平上重新连接中断的基因片段,剪接有可能使得这种转座子 DNA 插入在表型上沉默。然而,这种反应会切断 3′剪接位点的支架序列和引导序列,从而与正常的 ωRNA 成熟相冲突。这些作者推测 IStron 序列趋同是为了满足这些相互排斥的分子要求,从而平衡转座子保留和传播的需要,同时限制其适应性成本。
在利用系统性生物信息学方法分析了多种细菌 IStron之后,这些作者从肉毒梭菌(Clostridium botulinum)中选择了一个候选元件(即CboIStron),并在异源大肠杆菌宿主中重建了 DNA 转座、RNA 剪接和 RNA 引导的 DNA切割。他们的数据显示这种TnpAS转座酶和I组内含子分别在DNA和RNA水平介导了相同核苷酸序列的无痕重接,突出了对左端和右端序列的趋同识别。转座通过一种环状中间体发生,并且靶向GG 二核苷酸目标位点以便实现DNA 整合,这与 TnpB 在 RNA 引导的 DNA 切割过程中识别的转座子邻接基序相匹配。
当监测转座子拷贝数在 TnpA 和 TnpB 存在下的变化时,这些作者发现 IS607 编码的 TnpB 核酸酶与 IS605 元件中的对应物一样,靶向无痕供体连接点进行DNA切割,并通过 recA 依赖性同源重组驱动转座子保留。有针对性的遗传扰动确定了对ωRNA和I组内含子功能都至关重要的区域,这进一步证明了剪接和TnpB活性是相互冲突的。特别是,ωRNA 的结构特征本身会抑制剪接,而在 TnpB 存在的情况下,这种效应会增强。来自塞内加尔梭菌(Clostridium senegalense)的两种天然IStron(CseIStron-1 和 CseIStron-2)就体现了这些拮抗特征,它们在剪接或向导RNA 成熟方面交替具有高度活性,但不能同时具有这两种活性。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


