“类器官”点亮溃疡性结肠炎研究之路:hiPSC-COs模型的构建与探索
来源:生物谷原创 2024-11-11 13:56
本研究从hiPSC系分化出hiPSC-COs,确定了诱导其炎症的条件,处理后的hiPSC-COs呈现多种特征,与UC患者相似且对药物有反应,为UC病理机制和药物研发提供了准确模型。
炎症性肠病(IBD)是困扰医学界的一大难题,患者肠道长期遭受炎症折磨,腹泻、腹痛等症状频发,现有的类固醇、5-氨基水杨酸和Janus激酶抑制剂等治疗手段效果不尽人意,缓解率低于60%。IBD的病因错综复杂,遗传易感性、环境诱因以及肠道菌群失调等因素相互交织,导致患者肠道内免疫细胞过度分泌TNF-α、IFN-γ和IL-1β等炎症细胞因子,进而破坏结肠的内稳态。
人类结肠是一个由多种细胞构成的复杂器官,其中结肠上皮细胞承担着吸收水分和矿物质、分泌黏液等重要功能,基质细胞则负责维持结肠的平衡。然而在IBD患者体内,这种平衡被打破,上皮细胞代谢相关基因改变,表达炎症细胞因子的成纤维细胞增多。此前,研究人员尝试用Caco-2细胞或从溃疡性结肠炎(UC)患者结肠活检获取的类器官来模拟IBD病理生理过程,但Caco-2细胞源于结肠癌,与正常上皮细胞差异较大,活检类器官则主要是上皮细胞,基质细胞过少,无法准确模拟肠炎,这为研究IBD带来了阻碍。
近日,日本京都大学Kazuo Takayama研究团队在iScience发表了题为Establishment of an ulcerative colitis model using colon organoids derived from human induced pluripotent stem cells的研究论文。从健康个体外周血细胞建立的hiPSC系分化出含上皮和基质细胞的结肠类器官hiPSC-COs,并用TNF-α、IFN-γ和IL-1β处理模拟炎症环境。结果显示处理后的hiPSC-COs出现炎症反应和上皮细胞损伤,分子特征与UC患者结肠相似,且托法替尼(Tofacitinib)可改善其炎症状态。此研究为UC病理机制研究和药物研发提供了重要工具。

hiPSC-COs的生成
研究人员从健康个体外周血细胞建立的hiPSC系1383D6着手,通过一系列复杂的分化步骤成功获得了包含结肠上皮和基质细胞的hiPSC-COs。在分化过程中,不同阶段呈现出各异的细胞形态。基因表达分析结果显示,hiPSCs能够有效地分化为结肠上皮细胞,多种结肠相关标志物得以表达,例如肠道上皮细胞标志物、杯状细胞标志物等。并且,经过单细胞RNA测序分析发现,其细胞组成与人类结肠具有相似性。
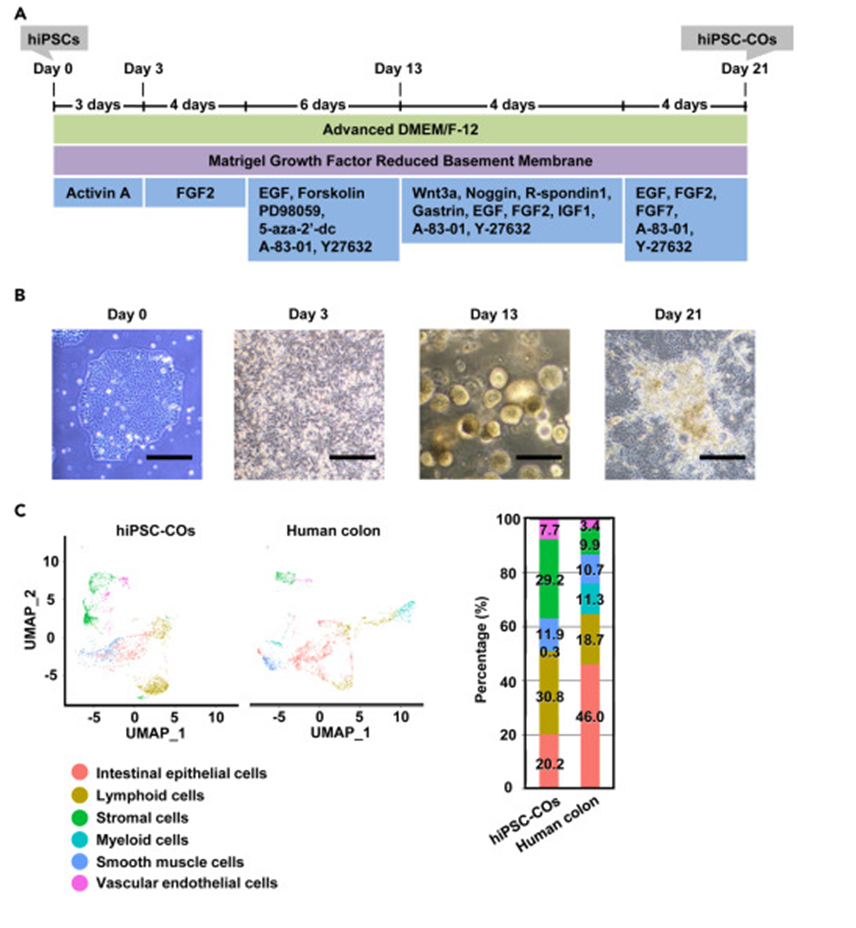
图1. 包含结肠上皮细胞和基质细胞的hiPSC-Cos的生成
hiPSC-COs的炎症诱导
用TNF-α、IFN-γ和IL-1β处理hiPSC-COs,发现不同浓度和处理时间对炎症细胞因子产生和细胞活力有影响。最终确定30 ng/mL TNF-α、30 ng/mL IFN-γ和10 ng/mL IL-1β(3CK)组合处理8天可有效诱导炎症反应,增加多种炎症细胞因子产生,同时降低细胞活力。
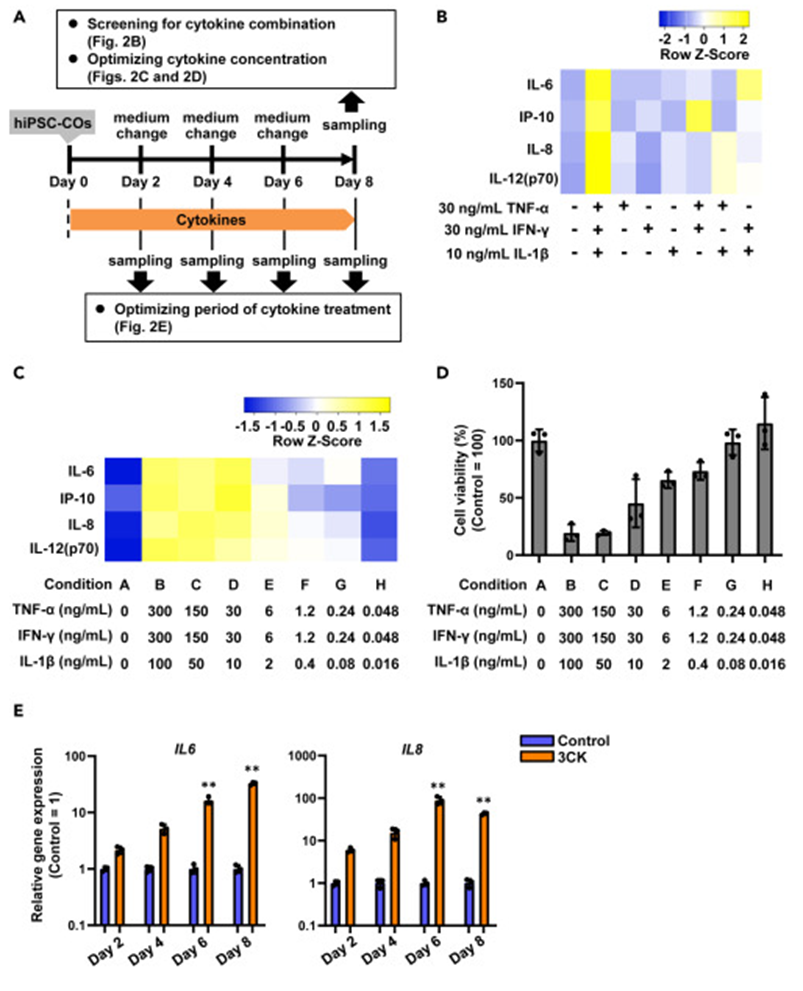
图2. 细胞因子筛选诱导hiPSC-COs的炎症反应
3CK处理后hiPSC-COs的特征
H&E染色显示,3CK处理后hiPSC-COs出现核消失和细胞聚集等形态变化,免疫荧光显示细胞肿胀和紧密连接蛋白ZO-1定位改变。肠道屏障功能检测显示,3CK处理后hiPSC-COs的TEER值降低,Papp值升高,表明肠道屏障被破坏,且肠道上皮细胞标志物Villin蛋白水平降低,表明上皮细胞受损。3CK处理后,hiPSC-COs的炎症细胞因子基因表达增加,多种细胞因子产生增加,如IL-8增加约25倍。同时,与生物防御相关的基因如DEFB4A表达增加,以及与活性氧产生相关的DUOX2和DUOXA2基因表达增加,且出现细胞毒性。3CK处理的Caco-2细胞也有炎症细胞因子基因表达和产生增加,但hiPSC-COs对细胞因子更敏感,且Caco-2细胞在3CK处理后未出现上皮细胞损伤。
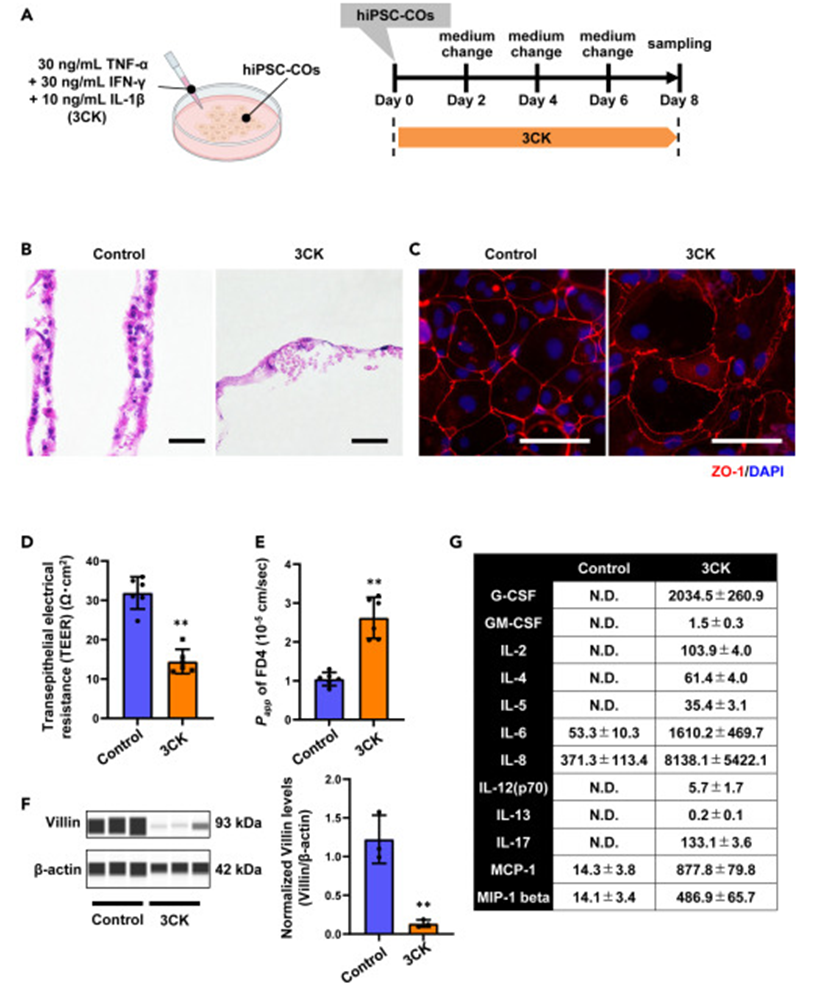
图3. TNF-α、IFN-γ和IL-1β处理hiPSC-COs的特征
3CK处理后hiPSC-COs的单细胞水平分析
通过单细胞RNA测序分析,发现3CK处理后的hiPSC-COs中炎症细胞因子在基质和血管内皮细胞簇中高表达,表明这些细胞是炎症细胞因子的主要来源。
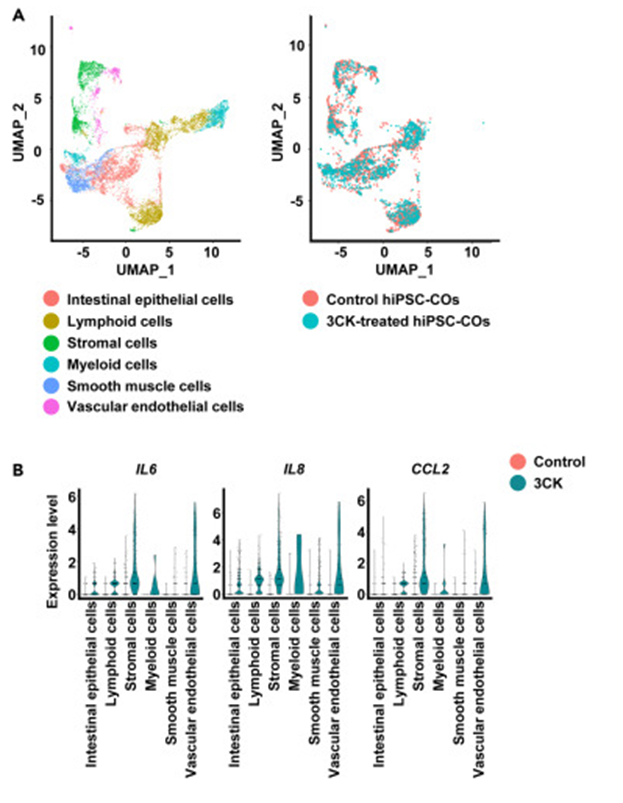
图4. 3CK处理后hiPSC-COs的单细胞水平分析
与UC患者比较
通过计算相关系数比较基因表达谱,发现3CK处理的hiPSC-COs与UC患者的相关性系数高于与克罗恩病患者的相关性系数,且UC相关基因在3CK处理的hiPSC-COs中有相似的表达变化,如DUOX2、CHI3L1和PI3表达增加,HMGCS2和UGT2A3表达降低。单细胞RNA测序数据比较显示,3CK处理的hiPSC-COs和UC患者结肠的基质细胞簇中分别有部分基因上调,且基因本体富集分析表明两者在炎症反应相关基因上有相似富集。
药物治疗验证
用Tofacitinib处理3CK处理后的hiPSC-COs,发现Tofacitinib无细胞毒性,且能逆转3CK处理导致的炎症细胞因子基因表达和分泌增加,恢复结肠上皮标志物基因表达,提高细胞活力,改善细胞肿胀和ZO-1定位改变等情况。
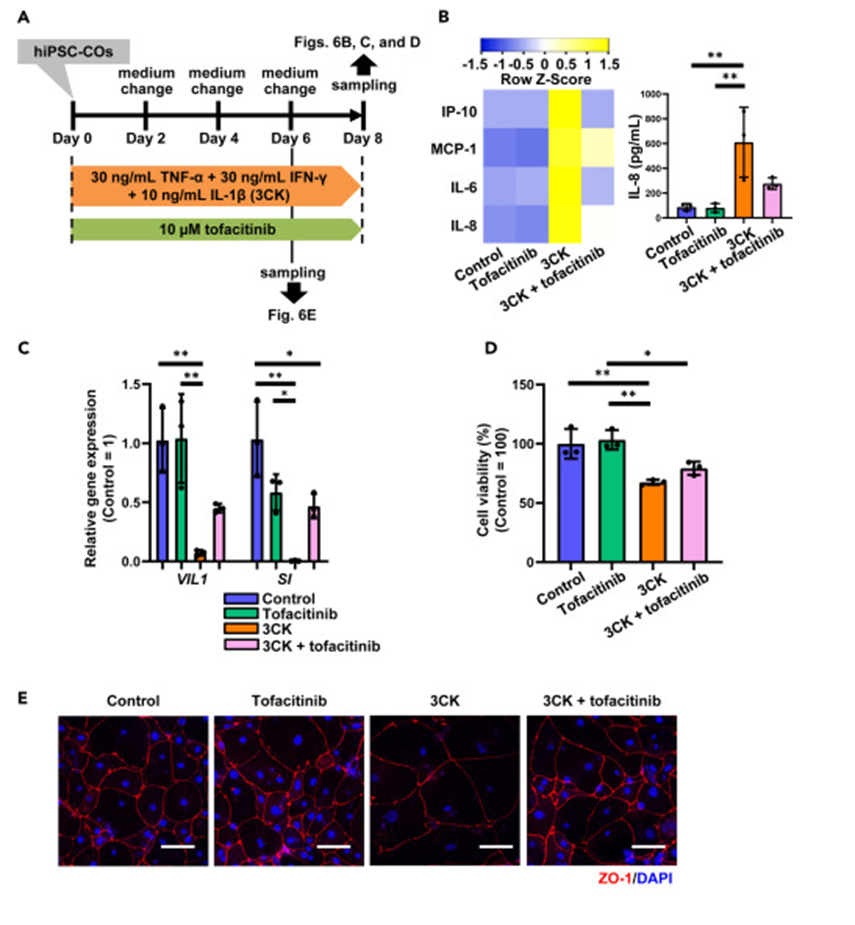
图5. 药物治疗验证
总体而言,本研究成功从hiPSC系分化出含上皮和基质细胞的hiPSC-COs,并确定30 ng/mL TNF-α、30 ng/mL IFN-γ和10 ng/mL IL-1β(3CK)组合处理8天可有效诱导炎症反应。3CK处理后的hiPSC-COs出现核消失、细胞聚集等形态变化,肠道屏障功能受损,上皮细胞标志物蛋白水平降低,炎症细胞因子基因表达和产生增加,且与Caco-2细胞相比对细胞因子更敏感且有上皮细胞损伤。单细胞RNA测序分析表明炎症细胞因子在基质和血管内皮细胞簇中高表达。与UC患者比较,基因表达谱等相似,且Tofacitinib可改善3CK处理后的hiPSC-COs炎症状态。本研究为研究UC病理机制提供了更准确的模型,能够深入探究炎症反应和上皮细胞损伤的机制。同时,该模型有助于UC药物的研发和筛选,可更好地评估药物疗效,为治疗UC带来新的思路和方法,有望推动UC治疗领域的发展。(生物谷Bioon.com)
参考文献:
Yokoi F, Deguchi S, Watanabe Y, Takayama K. Establishment of an ulcerative colitis model using colon organoids derived from human induced pluripotent stem cells. iScience. 2024;27(10):111049. Published 2024 Sep 26. doi:10.1016/j.isci.2024.111049
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


