科研人员首次发现肠道细菌介导遗传性视网膜疾病,并提出抗菌/肠道基因治疗的全新防控方法
来源:中山大学 2024-03-17 10:49
新研究成果开辟了CRB1相关遗传性致盲眼病与肠道微生物的全新研究方向,给CRB1相关遗传性致盲眼病的治疗带来了新曙光,并可能对更广泛的眼部疾病产生影响。
遗传性视网膜变性疾病是一类严重的不可逆致盲疾病,迄今几乎无药可医。其中,CRB1基因突变是最常见的导致Leber先天性黑矇和视网膜色素变性的病因之一。
为寻找针对CRB1基因突变相关的视网膜色素变性疾病的机制和治疗方法,中山大学中山眼科中心等科研单位组织科研人员进行了近10年的科研攻关,于近日取得突破性进展:发现CRB1基因突变导致的视网膜色素变性样损伤依赖于肠道微生物入侵,肠道中的细菌可通过被破坏的肠道屏障和眼部血视网膜屏障移行至视网膜,从而诱发视网膜炎症和色素变性样损伤。通过广谱抗生素全身治疗或在下消化道重新引入功能性Crb1表达,成功地预防了眼部疾病的发生和进展。这一工作颠覆了传统上认为人类眼内无菌的认知,将对遗传性视网膜变性疾病的治疗产生巨大的影响。

研究概览图
遗传性视网膜变性是与基因突变密切相关的疑难罕见眼病
遗传性视网膜变性是一组异质性疾病的总称,它实际上有250多个相关基因,其中之一就是CRB1。在全球范围内,10%~15%的Leber先天性黑矇以及4%的视网膜色素变性均归因于CRB1突变。CRB1是一种跨膜蛋白,在细胞间粘附连接复合体中至关重要。在Crb1基因发生移码突变造成完全功能缺失的retinal degeneration 8(Rd8)小鼠中,视网膜进行性损伤与部分CRB1基因突变导致的视网膜色素变性病人中出现的眼底变化非常近似。
Rd8小鼠视网膜上的退行性改变依赖于微生物侵入
在胚胎阶段并非所有Rd8小鼠都存在视网膜发育不良,但在出生后12天小鼠都出现了典型病变。RNA测序发现,Rd8小鼠视网膜中Slamf1和Ncf4这类“细菌与病毒识别”有显著关联的基因表达增高,促炎基因以及小胶质细胞和巨噬细胞浸润基因也显著上调,提示Rd8小鼠视网膜变性存在病原体的参与,而且伴有局部的先天免疫反应。
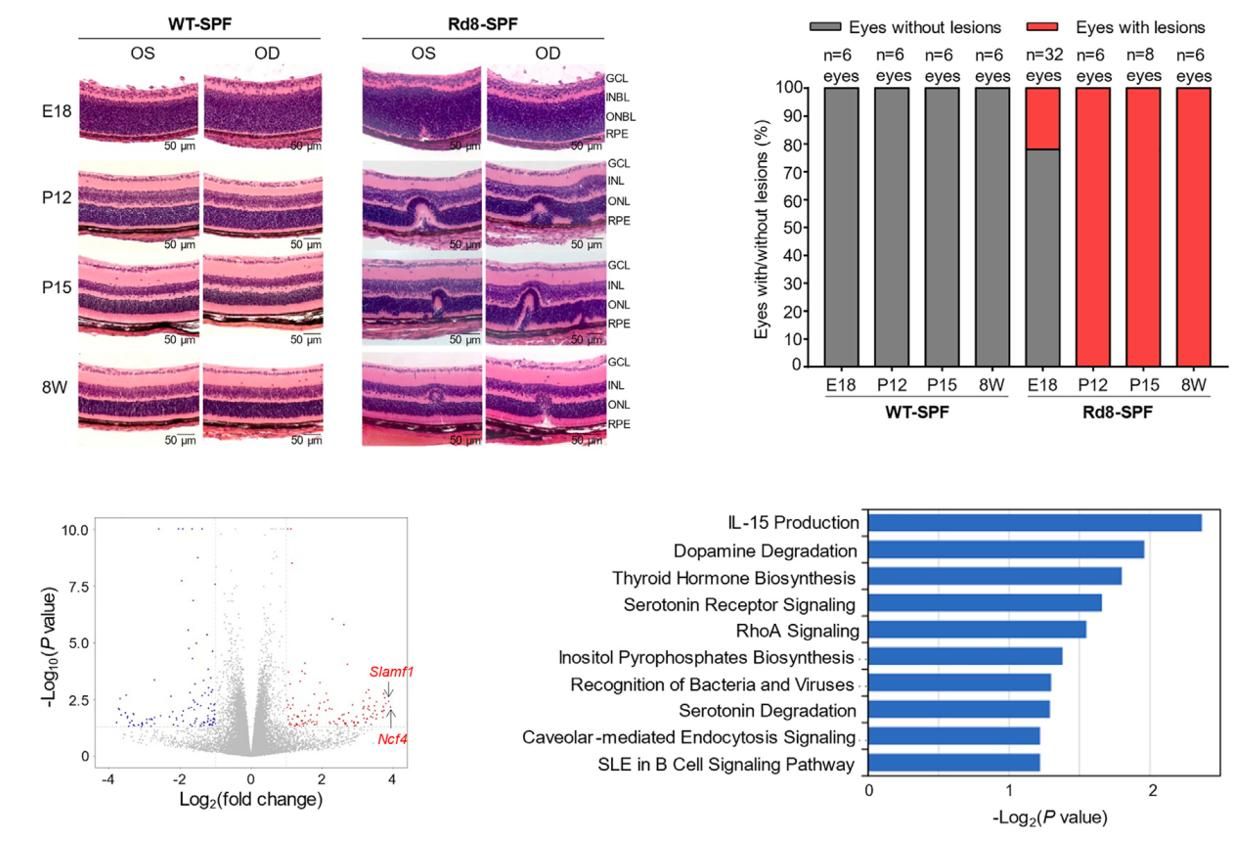
Rd8小鼠视网膜眼底局部免疫反应介导的组织损伤
通过对Rd8小鼠视网膜宏转录组测序发现,有7种细菌现身于视网膜变性区域,其中多达5种是已知的肠道细菌。
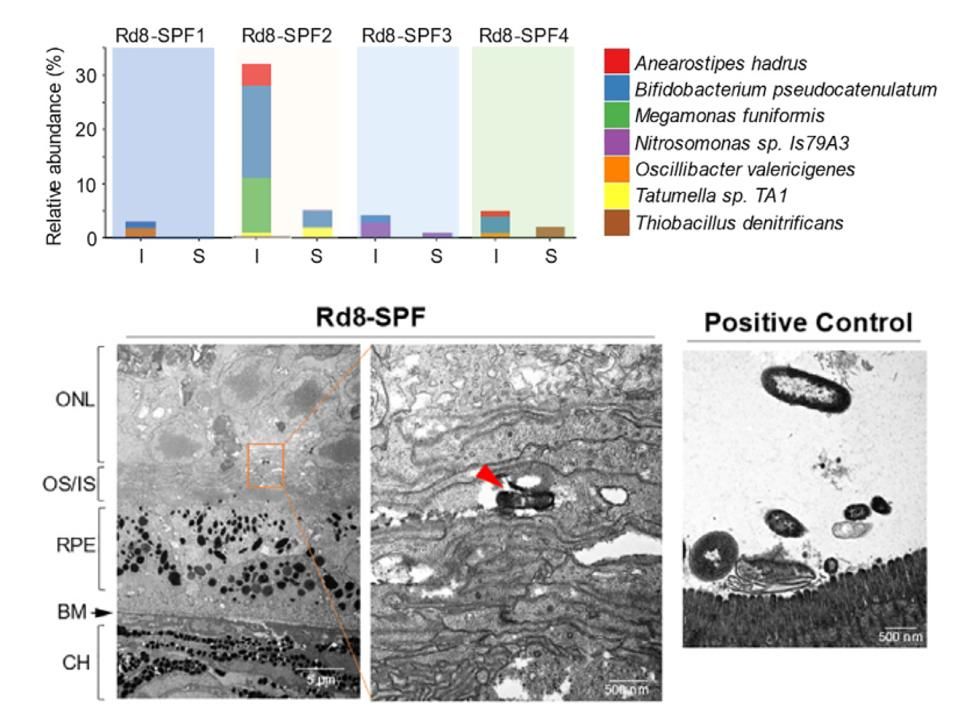
Rd8小鼠视网膜中发现肠道共生的细菌
Crb1基因的功能缺失导致血-视网膜屏障和结肠上皮屏障都出现功能障碍
Crb1基因的功能缺失导致肠道屏障结构破坏,促使肠腔内细菌进入血液循环。同时,因Crb1基因的功能缺失导致的视网膜色素上皮细胞间的连接复合体功能缺失,致使外周血内的少量细菌同样可以经过血视网膜外屏障的破坏处进入视网膜组织内部,造成炎症和视网膜损伤。
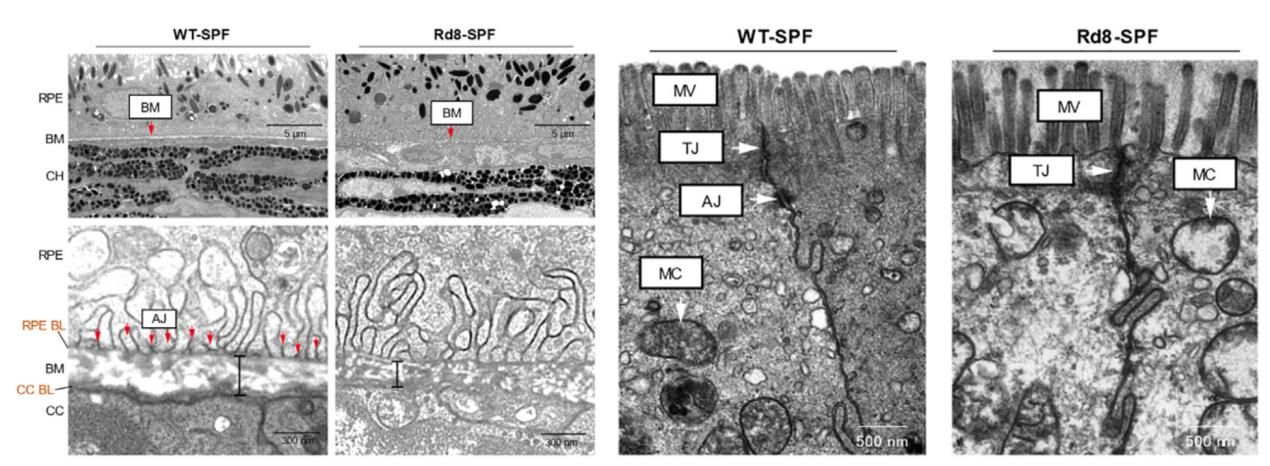
Crb1基因的功能缺失破坏了血-视网膜屏障和结肠上皮屏障完整
靶向细菌治疗可有效地减轻视网膜的损伤
目前,对于遗传性视网膜变性疗法的开发主要集中于基因疗法。在本研究中发现,给Rd8小鼠施用广谱抗生素,可以有效减轻视网膜的损伤、避免进一步的变性。
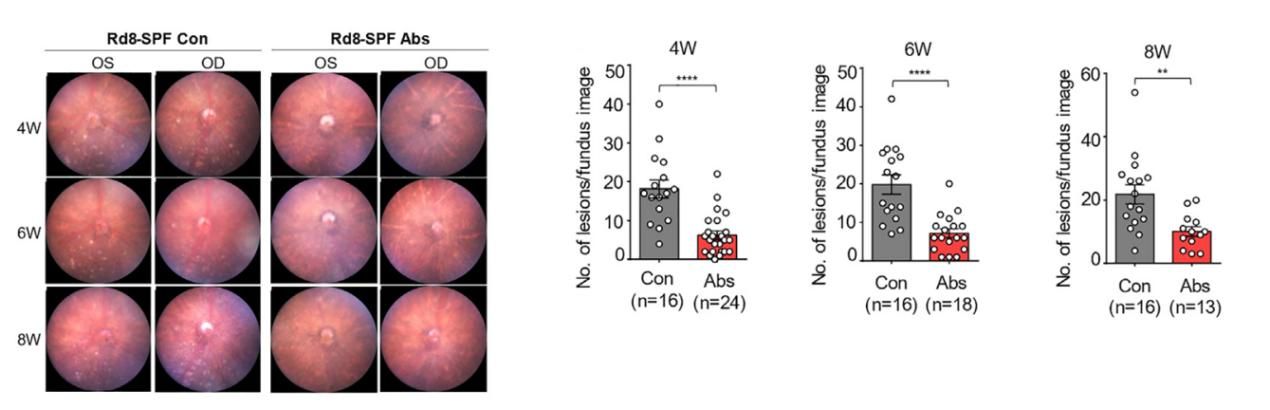
广谱抗生素疗法显著减少了视网膜病变的数量和大小
这一成果开辟了CRB1相关遗传性致盲眼病与肠道微生物的全新研究方向,给CRB1相关遗传性致盲眼病的治疗带来了新曙光,并可能对更广泛的眼部疾病产生影响。
本论文是中山大学中山眼科中心在Cell杂志上的首篇论文,中山大学中山眼科中心、眼病防治全国重点实验室为论文第一作者单位和通讯作者单位,中山大学中山眼科中心博士研究生彭善珍、李晔、梁桥星、曾磊,硕士研究生宋宛莹,以及副研究员李竞婧为共同第一作者,魏来教授、张峰教授、Richard Lee教授、魏泓教授为论文的共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


