想知道肠道如何工作?Nat Commun:用EREG培育出带神经元和血管的肠道类器官,还原肠道关键功能!
来源:生物谷原创 2025-03-31 11:42
研究发现,Epiregulin可促进人肠道类器官分化,使其具备多种细胞类型。移植后类器官成熟且功能增强,有蠕动样功能和功能性血管,为肠道研究及相关疾病治疗提供了更有效的模型。
在人体的复杂生理系统中,肠道占据着举足轻重的地位。它不仅承担着消化食物、吸收营养的关键职责,还在免疫调节等方面发挥着重要作用。然而,肠道相关疾病的研究和治疗一直面临诸多挑战,这与肠道生理结构和功能的复杂性密切相关。人肠道类器官(HIO)作为研究肠道的有力工具,近年来受到了广泛关注。但传统的HIO存在一些不足,限制了其在医药领域的应用。
近期,发表于Nat Commun的一项研究Pupil size reveals arousal level fluctuations in human sleep为该领域带来了新进展。此前,HIO由诱导多能干细胞(iPSCs)培养而来,能模拟人类肠道的部分特征,有助于研究肠道的发育、生理和病理情况。不过,体外培养的HIO通常结构较为简单,缺少神经元、内皮细胞和有组织的平滑肌等关键细胞类型,这使得它难以完全重现肠道的复杂功能。

此次研究中,科研人员聚焦于肠道干细胞微环境因子Epiregulin(EREG)。已有研究显示,EREG在人类肠道发育进程中意义重大,有可能成为提升HIO分化水平的关键因素。
在研究结果方面,科研人员取得了一系列重要发现。在生成包含多种关键细胞的HIO上,实验数据表明,使用10 ng/mL EREG培养的HIO形成效率相对较高。通过单细胞RNA测序、免疫荧光染色等多种检测技术分析发现,这类HIO中含有丰富的平滑肌、神经元和内皮细胞等多种细胞类型。与传统EGF培养的HIO相比,其细胞比例和基因表达情况更具优势。进一步研究发现,早期让细胞暴露于EREG环境,能促进多种细胞系的基因表达,但长时间在EREG或EGF环境中培养,部分细胞群体的数量会有所减少。
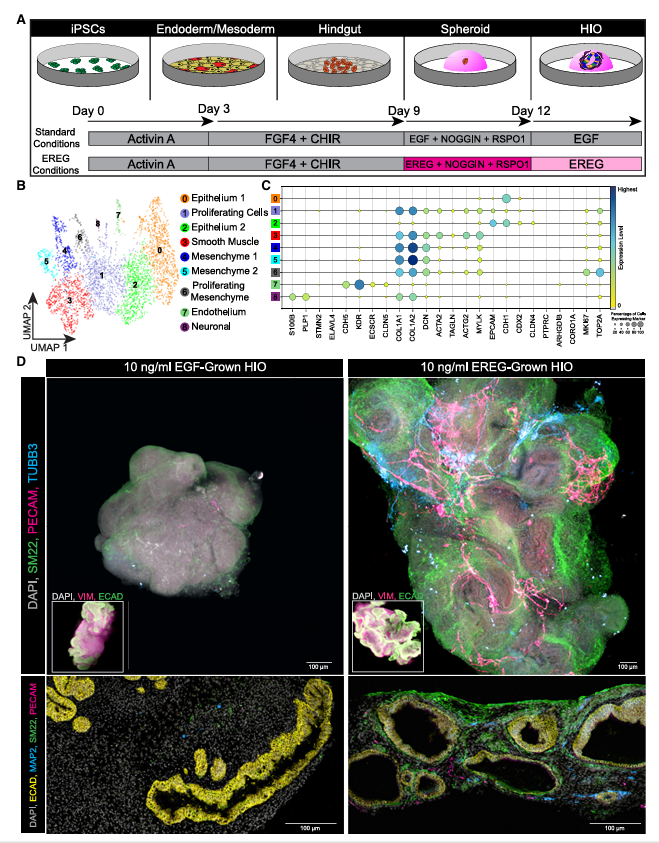
图 1:体外培养的EREG-HIOs自发且同时形成内皮、平滑肌和神经成分
其次,移植后的EREG-HIO表现出更强的成熟和组织化能力。科研人员将HIO移植到免疫缺陷小鼠的肾包膜下,观察到EREG-HIO在小鼠体内成熟度明显增加,细胞组织更加有序。经过深入分析发现,这些细胞的转录状态与人类肠道细胞相似,这意味着EREG-HIO在模拟人体肠道方面更接近真实情况。
功能测试结果显示,EREG-HIO具有出色的功能性。在对EREG-tHIOs进行功能测试时发现,在没有外界刺激的情况下,它能够自发产生节律性收缩,这一现象表明其内部可能存在功能性神经肌肉单元。当使用毒蕈碱受体激动剂和拮抗剂进行刺激时,EREG-tHIOs能够做出相应的反应,进一步证实了功能性神经肌肉单元的存在。研究还发现,神经元能够有效调节平滑肌的收缩,使整个神经肌肉系统协同运作。
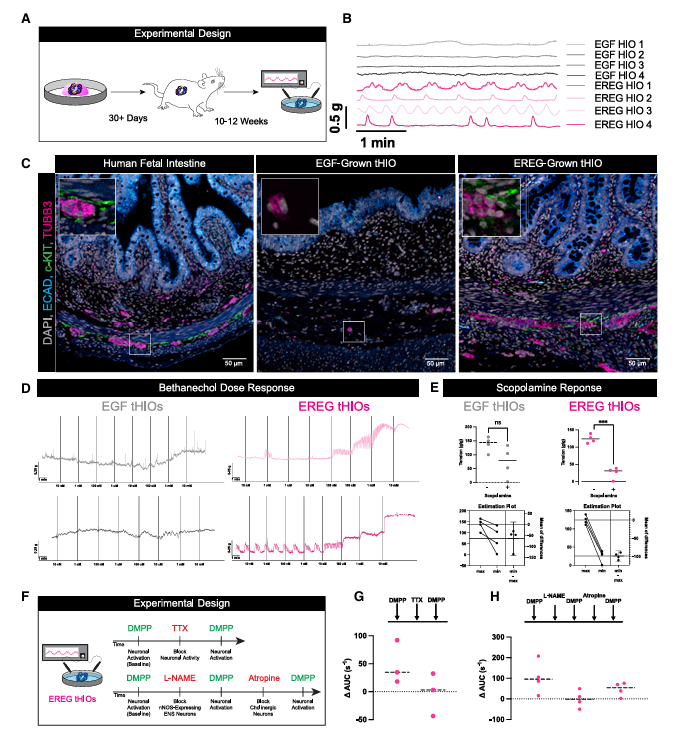
图 2:评估EREG培养的tHIOs的神经肌肉单元和天然功能
在血管功能方面,EREG-HIO同样表现出色。研究证实,EREG-HIO中含有大量的内皮细胞,这些细胞能够在体内外与循环系统成功连接,形成功能性血管,实现血液的灌注。这一成果为研究肠道血管相关疾病提供了更有效的模型。
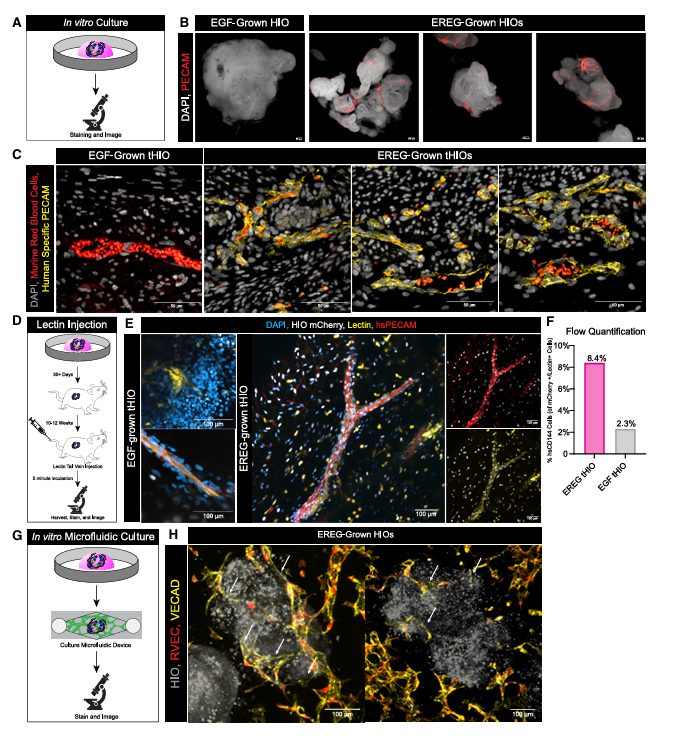
图 3:EREG培养的HIOs形成在体内外均具有功能的血管
总的来说,这项研究利用EREG成功构建出了更复杂、功能更完善的HIO模型。该模型包含多种关键细胞类型,能模拟肠道的重要功能,为肠道相关疾病的研究、药物研发以及再生医学的发展提供了有力的工具。随着相关研究的持续推进,有望为肠道疾病的治疗带来新的突破,为人类健康事业做出更大贡献。(生物谷Bioon.com)
参考文献:
Carro-Domínguez M, Huwiler S, Oberlin S, et al. Pupil size reveals arousal level fluctuations in human sleep. Nat Commun. 2025;16(1):2070. Published 2025 Feb 28. doi:10.1038/s41467-025-57289-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


