Mol Cell封面论文:浙江大学林爱福等解码肝癌微肽组,并开发新型微肽类靶向药物前体
来源:生物世界 2025-06-23 10:12
这项研究挑战了传统的编码与非编码基因的二元划分,展示了非经典蛋白质组在癌症生物学研究中的巨大潜力。
人类基因组的复杂性令人叹为观止,但仅约1%的基因编码约两万种蛋白质,而其中被深入研究的仅有几千种,被认为具有作为药物或检测靶点的更是屈指可数。陆续有研究表明,人类基因组中曾被认为不具备编码功能的非编码区,同样蕴藏着编码蛋白质的潜力。这些如同“暗物质”般神秘的未被充分研究蛋白质,可能蕴藏着治疗包括癌症在内多种疾病的关键钥匙,其系统鉴定将为生物学与医学研究带来新思路。
近期,浙江大学林爱福与周天华团队在人类胃癌等组织样本中鉴定出近万个尚未被充分解析的新型微肽,并借助人工智能(AI)技术对其功能进行了系统注释,为肿瘤等恶性疾病的预防和干预提供了新的靶点和思路。
相关论文以:Comprehensive Discovery and Functional Characterization of the Noncanonical Proteome 为题,作为封面报道(Cover Story)于 2025 年 3 月 14 日发表于 Cell Research 期刊【1】。同期的研究点评中,来自德国马克斯·德尔布吕克分子医学中心的基因组学专家 Norbert Hübner 教授对该项工作做出高度评价:这项研究挑战了传统的编码与非编码基因的二元划分,展示了非经典蛋白质组在癌症生物学研究中的巨大潜力。

上述前期发现为微肽功能解析提供了相关理论与技术支撑。研究团队进一步聚焦于肝癌相关微肽,并对其作为天然抗肿瘤药物的潜力进行深入挖掘。
2025 年 6 月 19 日,浙江大学林爱福、周天华及袁瑛等团队在 Cell 子刊 Molecular Cell 发表题为:Hepatic micropeptide modulates mitochondrial RNA processing machinery in hepatocellular carcinoma 的封面论文【2】。
该研究鉴定了肝癌组织来源的微肽并进行了系统功能注释,揭示了线粒体微肽 MRPIP 响应能量应激,调控线粒体内功能复合体组装和能量代谢,从而抑制肝癌增殖的功能,并据此发现了肝癌天然微肽类靶向药物前体分子。

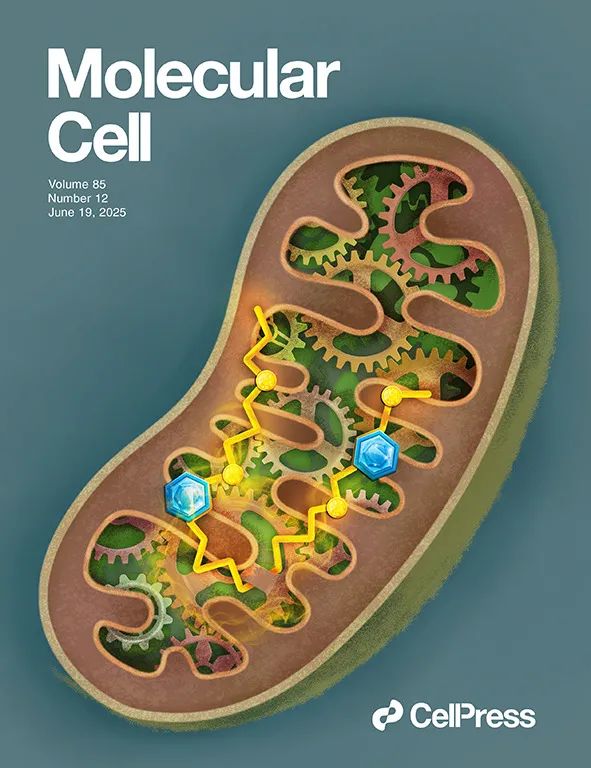
研究团队首先采用超滤浓缩串联质谱技术,从肝癌临床样本中鉴定得到 1532 个新型微肽,并开发了一个基于 AlphaFold2 结构预测和肽-蛋白质互作网络的功能预测模型,对微肽进行了系统功能注释。分析揭示微肽广泛分布于各种亚细胞结构中,具有与蛋白复合体结合、组装和调控相关的潜在生物学功能。进一步通过公共数据库筛选和临床样本分析,发现 lncRNA AC027045.3 编码的微肽 MRPIP 在肝癌组织中表达显著下调并与不良预后显著相关,进一步细胞定位分析,发现微肽 MRPIP 位于线粒体基质。
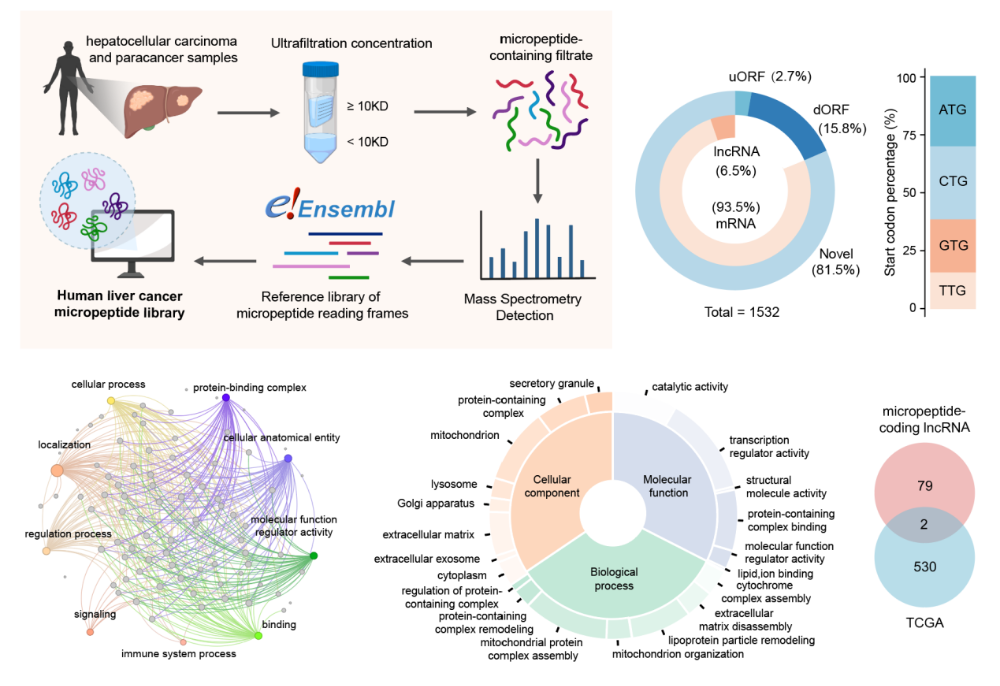
肝脏作为人体内线粒体含量和密度最高的器官之一,线粒体功能异常与肝癌发生发展密切相关。线粒体作为半自主细胞器,拥有独立的基因组以及基因表达系统。不同于核编码 RNA,线粒体 RNA(mtRNA)以多顺反子的形式转录,当 tRNA 从初级转录物上被剪切分离后,剩余的片段即被加工为 mRNA 和 rRNA。因此前体 mtRNA 的剪切过程决定了线粒体mRNA的可用性,对线粒体基因表达产生重要影响。
在增殖活跃的肝癌肿瘤细胞中,线粒体基因表达系统高度激活,然而尚不清楚这一过程是否涉及 mtRNA 剪切的异常调控。深入研究 mtRNA 剪切过程在肝癌进展中的作用和调控机制,有望为肝癌线粒体靶向治疗提供理论基础。
研究团队通过进一步质谱筛选鉴定及非变性电泳分析,发现 MRPIP 结合线粒体 RNA 剪切复合体 mtRNase P 的亚基 HSD17B10,破坏其四聚化及其与另一亚基 TRMT10C 的结合。MRPIP 介导的 mtRNase P 复合物组装抑制,并进一步导致线粒体 RNA 加工、蛋白翻译和能量代谢受到干扰,最终抑制肿瘤增殖。生物大分子的合成与细胞能量供应高度相适。通过 ChIP-qPCR 检测和一系列敲除回补实验,研究团队证明转录因子 FOXO1 在葡萄糖饥饿条件下转录上调 MRPIP,从而抑制 mtRNase P 的组装和活性,下调线粒体翻译。以上研究揭示了 MRPIP 响应能量应激,抑制线粒体翻译的节点调控功能。
基于上述功能机制解析,研究团队基于微肽 MRPIP 的功能结构域设计合成了 20 个氨基酸的微肽药物前体分子——PMHR。借助体外肿瘤细胞模型及体内小鼠肝癌模型,证明 PMHR 可不依赖于递送载体进入肿瘤细胞线粒体,通过靶向 mtRNase P 抑制线粒体翻译和能量代谢,有效抑制了肝癌恶性进程。
综上所述,该研究系统鉴定并注释了肝癌相关微肽,发现了微肽作为细胞内蛋白复合体调控元件的生物学功能,揭示微肽作为内源性生物活性小分子,为肿瘤靶向药物的开发提供新策略和新思路。
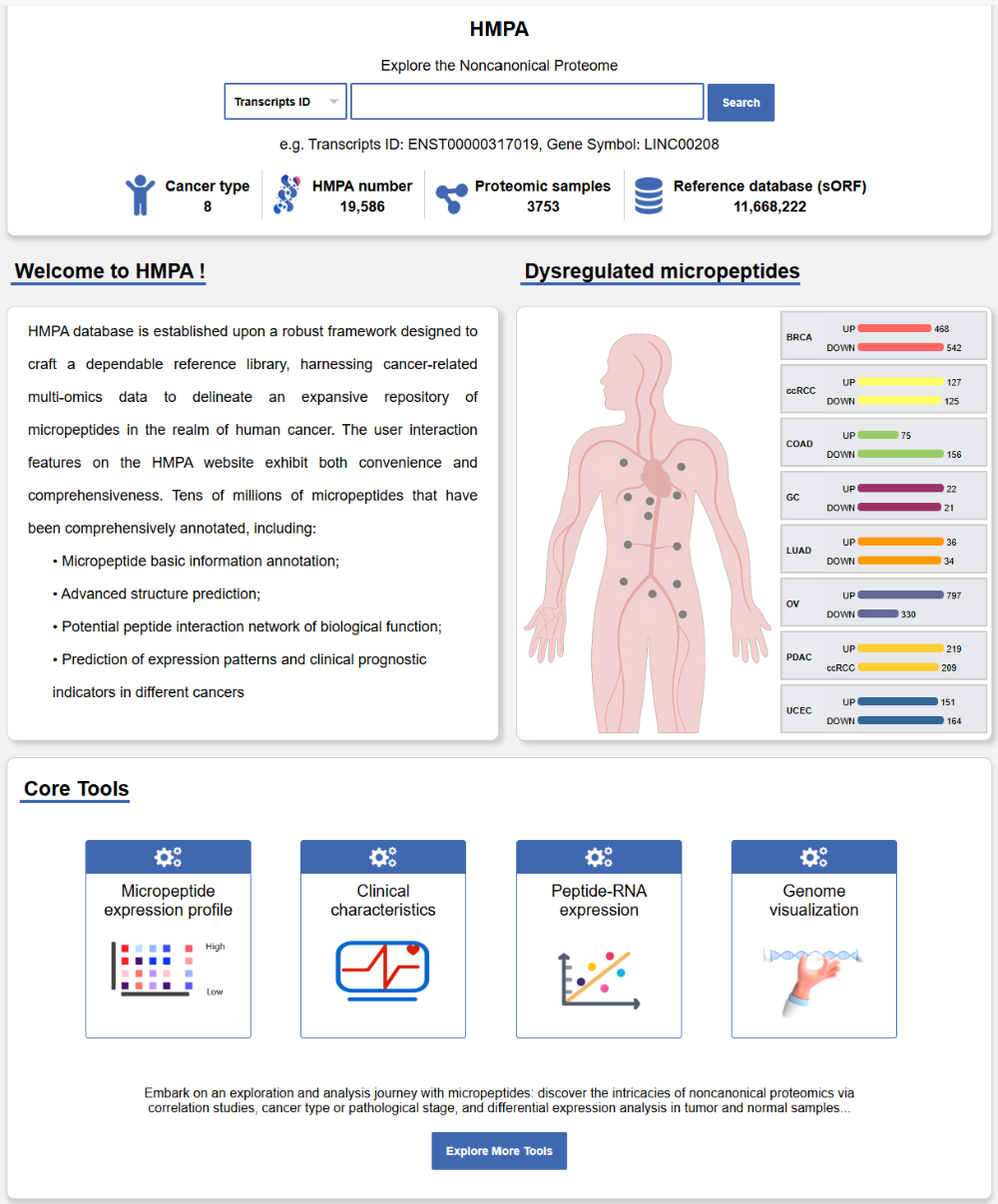
该研究鉴定得到的微肽与团队前期研究成果均收录于团队自主构建的可访问的可视化数据集:人类微肽谱图(Human Micropeptide Atlas, HMPA),并于 2024 年 9 月 23 日以:HMPA: A Pioneering Framework for the Noncanonical Peptidome from Discovery to Functional Insights 为题发表于 Briefings In Bioinformatics 期刊【3】。通过对公共数据库中的蛋白质组数据和自测数据的从头分析,该数据集还包含从包括乳腺癌、肾透明细胞癌等 8 类癌种中鉴定到的约 2 万个非编码 RNA 来源的微肽,并将临床大数据中的预后、表达等作为特征值纳入整合分析。该数据库可通过 hmpa.zju.edu.cn 访问,后续将持续更新,将为微肽研究提供便捷、多维的可视化工具,为精准医学和后基因组治疗提供数据支持。
浙江大学林爱福教授、周天华教授、袁瑛教授为本论文的通讯作者。浙江大学诸林瑜、刘方舟、石成瑜与苏心婉为本论文的共同第一作者。研究工作也得到了浙江大学丁克峰教授、西湖大学李旭教授等合作者的大力支持。该团队欢迎对RNA生物医学、肿瘤生物学等方向感兴趣的青年才俊加盟(提供博士后及特聘研究员、副研究员等岗位)。
论文链接:
1. https://www.nature.com/articles/s41422-024-01059-3
2. https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00466-6
3. https://academic.oup.com/bib/article/25/6/bbae510/7824238
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


