Nat Cancer:新研究发现了卵巢癌和子宫癌的遗传弱点,有助开发新的疗法
来源:生物谷原创 2022-05-05 11:42
磷酸盐是生命所必需的,存在于骨骼和牙齿的矿物中,也存在于DNA的骨架中。
尽管在过去的20年里,一些类型的癌症患者的前景得到了改善,但子宫癌和卵巢癌患者的预后仍基本不变。患者在被诊断出之前往往已经是晚期疾病,而新的治疗方法很难靶向驱动肿瘤形成的基因。
如今,在一项新的研究中,来自布罗德研究所癌症依赖性图谱(Cancer Dependency Map, DepMap)项目的研究人员发现了卵巢癌和子宫癌中的一个隐藏的弱点以及利用它的方法,这可能会激发出治疗这些癌症的新的、急需的药物。相关研究结果发表在Nature Cancer期刊上,论文标题为“Phosphate dysregulation via the XPR1–KIDINS220 protein complex is a therapeutic vulnerability in ovarian cancer”。

在布罗德研究所主任Todd Golub和DepMap主任Francisca Vazquez的领导下,这些作者研究了851种人类癌症细胞系,以寻找子宫癌和卵巢癌严重依赖的基因,即依赖性基因。科学家们已经知道,子宫癌和卵巢癌细胞中一种叫做SLC34A2的蛋白含量很高,它能将磷酸盐导入细胞。Golub团队让这些癌细胞中另一种名为XPR1的蛋白---它将磷酸盐输出到细胞外---失活并发现这能杀死它们。这些结果表明XPR1基因是这些癌细胞的一个遗传弱点,磷酸盐的堆积可能对细胞有毒性。该团队补充说,破坏癌细胞中的磷酸盐运输,比如他们在实验中让XPR1蛋白失活,可能是一种有效的治疗策略。
Golub说,“卵巢癌患者迫切需要更好的治疗方法,而这项关于XPR1的发现作为药物发现的起点既令人惊讶又令人兴奋。如今面临的挑战将是把这一发现转化为一种治疗策略。”
Vazquez说,“这是癌症依赖性图谱发现的另一个伟大的例子,仅仅通过基因组测序是不可能发现新的癌症弱点。这是我们朝着绘制完整癌症脆弱性图谱的目标迈出的又一步。”这种癌症依赖性图谱使他们能够以不偏不倚的方式阐明生物途径并提出新问题。
Golub实验室博士后研究员Daniel P. Bondeson说,“磷酸盐平衡是你在癌症中可以靶向的对象,这个想法是以前没有人意识到的。”
布罗德研究所高级研究科学家Brenton R Paolella补充说,“最后,我们了解了细胞生物学的一些基本基础。不过,我们也发现了开发治疗方法的机会。而这是一个很好的例子,说明你可以用癌症依赖性图谱做什么。”
磷酸盐泛滥
磷酸盐是生命所必需的,存在于骨骼和牙齿的矿物中,也存在于DNA的骨架中。尽管之前的研究已显示卵巢癌细胞中的磷酸盐输入蛋白SLC34A2水平异常高,但是该蛋白存在于其他组织中,如肺部和肠道,因此用药物靶向它可能会导致副作用。
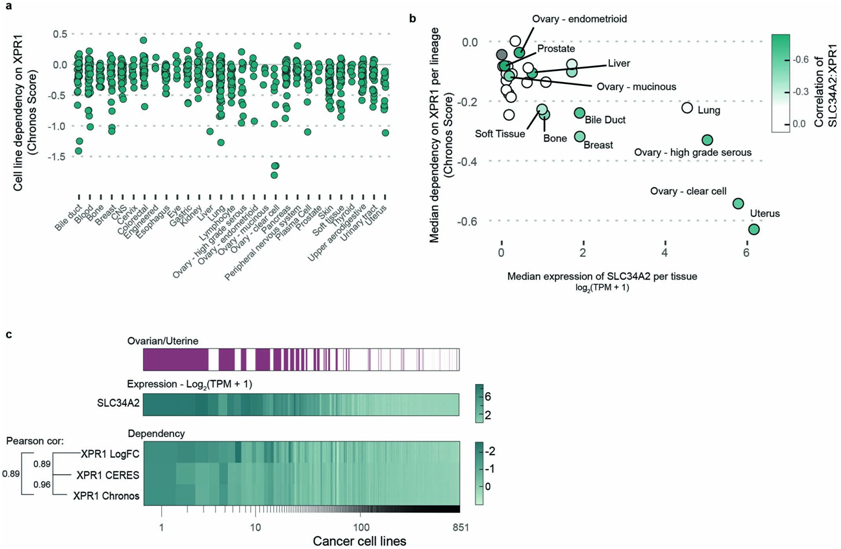
在高表达SLC34A2的癌细胞系中选择性观察到XPR1依赖性。图片来自Nature Cancer, 2022, doi:10.1038/s43018-022-00360-7。
为了给未来的治疗方法找到更好的靶标,这些作者专注于寻找子宫癌细胞和卵巢癌细胞特有的弱点。他们进行了针对DepMap 的CRISPR筛选,旨在探究让癌细胞中关键基因失活的效果。在这851种细胞系中,他们观察到当XPR1(编码唯一已知从细胞中输出磷酸盐的蛋白)被关闭时,子宫癌细胞和卵巢癌细胞比其他细胞更容易死亡。特别是,XPR1失活的癌细胞只有在输入大量磷酸盐时才会死亡。此外,在这些癌细胞中,最经常发现的另一个分子特征是存在高水平的SLC34A2蛋白。
接下来,Golub团队在存档的患者数据中发现了磷酸盐输入蛋白和磷酸盐输出蛋白之间的一些相关性的证据。Bondeson和Paolella说,这种相关性提出了一个明确的假设:磷酸盐的堆积本身是有毒的。
迈向治疗
回到实验室后,该团队测试了他们的理论。在卵巢和子宫癌细胞模型中,他们发现,当癌细胞高表达磷酸盐输入蛋白XPR1时,它们依靠这种蛋白生存。而当他们让XPR1失活或用一种蛋白抑制它时,癌细胞积累了磷酸盐,生长得更慢,并最终死亡。
这些作者说,这种他们用来抑制XPR1的蛋白经过进一步开发后可能成为这些癌症的潜在治疗方法,Golub实验室将继续研究这种蛋白是否是一种可行的治疗策略。
Bondeson说,“卵巢癌的一些基因依赖性很难用药物来靶向,但是我们发现我们实际上可以用一种蛋白来靶向XPR1并杀死癌细胞。这真地很令人兴奋。”
这些作者还观察到XPR1依赖性与另一个叫做KIDINS220的基因的依赖性密切相关,KIDINS220参与神经发育,但以前没有与磷酸盐运输联系起来。他们认为,XPR1和KIDINS220共同形成了一个参与将磷酸盐运出细胞的蛋白复合物。这种联系提供了大量的其他科学问题:KIDINS220是否也能成为新药物的靶标?与KIDINS220有关的疾病是否涉及磷酸盐调节问题?
Bondeson和Paolella说,KIDINS220参与磷酸盐运输表明,关于XPR1和KIDINS220如何相互作用以及如何与磷酸盐相互作用,还有很多东西需要学习,更根本的是,在科学上对细胞如何感知、调节和储存磷酸盐的理解仍然存在很大的差距。他们补充说,磷酸盐堆积究竟是如何杀死细胞的,还需要加以澄清。例如,他们注意到在装载磷酸盐的细胞的显微镜图片中出现了不寻常的膜包围的囊状物。他们不知道这些囊状物或者说空泡是否储存了额外的磷酸盐,或者是即将到来的死亡的标志。
Paolella说,“我们仍然对这些结果感到非常困惑,但是以一种令人兴奋的方式。我们的研究工作表明,关于磷酸盐平衡的一些非常基本的问题仍然是未知的。”(生物谷 Bioon.com)
参考资料:
1. Daniel P. Bondeson et al. Phosphate dysregulation via the XPR1–KIDINS220 protein complex is a therapeutic vulnerability in ovarian cancer. Nature Cancer, 2022, doi:10.1038/s43018-022-00360-7.
2. Researchers find genetic “Achilles heel” in ovarian and uterine cancers
https://www.broadinstitute.org/news/researchers-find-genetic-%E2%80%9Cachilles-heel%E2%80%9D-ovarian-and-uterine-cancers
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


