STTT:中山大学符立梧/王芳发现结直肠癌免疫逃避的新机制
来源:网络 2023-08-25 16:48
免疫检查点抑制剂(ICIs)在一部分结直肠癌(CRC)患者中诱导了持久的临床反应。然而,令人不满意的应答率和缺乏合适的生物标志物来选择合适的患者接受ICIs治疗,对目前的免疫疗法构成了重大挑战。炎症相
免疫检查点抑制剂(ICIs)在一部分结直肠癌(CRC)患者中诱导了持久的临床反应。然而,令人不满意的应答率和缺乏合适的生物标志物来选择合适的患者接受ICIs治疗,对目前的免疫疗法构成了重大挑战。炎症相关分子A20与癌症免疫反应密切相关,但A20对“吃我”信号和免疫治疗效果的影响仍然难以捉摸。
2023年8月23日,中山大学符立梧及王芳共同通讯在Signal Transduction and Targeted Therapy 在线发表了题为“A20 promotes colorectal cancer immune evasion by upregulating STC1 expression to block “eat-me” signal”的研究论文,该研究揭示A20通过上调STC1表达以阻断“吃我”信号促进结直肠癌免疫逃避。该研究发现A20下调显著改善了体外和体内CRC中抗肿瘤免疫反应和PD-1抑制剂的疗效。
较高的A20表达与CRC组织中免疫细胞(包括CD3(+)、CD8(+) T细胞和巨噬细胞)的浸润较少以及预后较差有关。增益和损失A20功能研究证明,A20可以通过上调stanniocalcin 1(STC1)、与CRT结合并滞留在线粒体中来降低细胞膜易位上的“吃我”信号钙网蛋白(CRT)。从机制上讲,A20抑制GSK3β在Thr86磷酸化STC1以减缓STC1蛋白的降解。总之,该研究的发现揭示了CRC中炎症分子A20和“吃我”信号之间的新串扰,这可能代表了一种新的预测性生物标志物,用于选择最有可能从ICI治疗中受益的CRC患者。

CRC是最常见的恶性肿瘤之一。局限性原发性疾病患者的5年生存率约为90%,有淋巴结或外周转移的患者约为70.4%,有远处转移的患者为12.5%。ICIs已被证明是许多恶性肿瘤的一种有前景的治疗方法,包括微卫星不稳定性(MSI)-高结直肠癌(CRCs)。ICI的作用是克服或减轻肿瘤诱导的免疫抑制,从而增强对癌症细胞的免疫反应,从而消除肿瘤。众所周知,肿瘤微环境(TME)中浸润的炎症细胞的丰度与ICIs的疗效密切相关。根据肿瘤突变负荷(TMB)和T细胞炎症基因的表达水平,TME有四种亚型。CRC通常分为两种类型,MSI高和微卫星稳定(MSS)。较高的体细胞TMB更有可能表达免疫原性新抗原,使其对ICIs有反应。相反,低TMB和低炎症基因特征通常表现为免疫沙漠或免疫细胞排斥的表型,这与低效或不存在的抗原呈递相关,从而导致较差的适应性免疫反应。因此,TMB低和炎症基因标记物低的患者在接受免疫治疗时通常表现出较差的临床结果。
尽管存活时间延长,但许多患者对ICIs具有先天或后天的耐药性。低反应率和缺乏合适的生物标志物来选择合适的患者进行ICI治疗,严重限制了ICIs在临床上的疗效。对肿瘤抗原的适应性免疫反应的启动需要抗原呈递细胞(APC)的摄取及其向幼稚T细胞的呈递。为此,在具有低TMB和低炎症基因特征的肿瘤中,APC向肿瘤组织的浸润是有缺陷的。因此,旨在克服这一限制并进一步支持肿瘤组织中T细胞功能的新疗法可能对这类肿瘤患者大有裨益。
吞噬作用在癌症的监测中很重要。它受癌症细胞表面几个分子“吃我”信号的调节,这些信号允许识别细胞外货物,随后激活吞噬受体和其他下游信号级联。钙网蛋白(CRT)是一种46 kda的可溶性蛋白,主要定位于内质网(ER),被认为是一种重要的“吃我”信号。在促凋亡的癌症细胞中,CRT作为“吃我”信号转移到细胞膜上,被APC(如DC和巨噬细胞)识别以激活特异性T细胞。APC启动和激活特异性T细胞,对确定ICIs治疗的成功至关重要。这一过程取决于APC是否能够通过吞噬作用有效地从促凋亡肿瘤细胞中捕获抗原,向T细胞提供足够的抗原,并激活T细胞。因此,CRT的膜移位是成功治疗ICI的关键步骤。STC1是一种激素样糖蛋白,已被证明可以调节钙和磷的稳态。肿瘤STC1可以与CRT相互作用,将CRT捕获在线粒体区域,然后降低膜CRT。因此,膜CRT介导的APC吞噬作用减弱,导致APC抗原呈递和T细胞活化受损。据推测,阻断“吃我”信号或其受体可能会损害APC介导的吞噬作用,并诱导对ICIs的治疗耐药性。
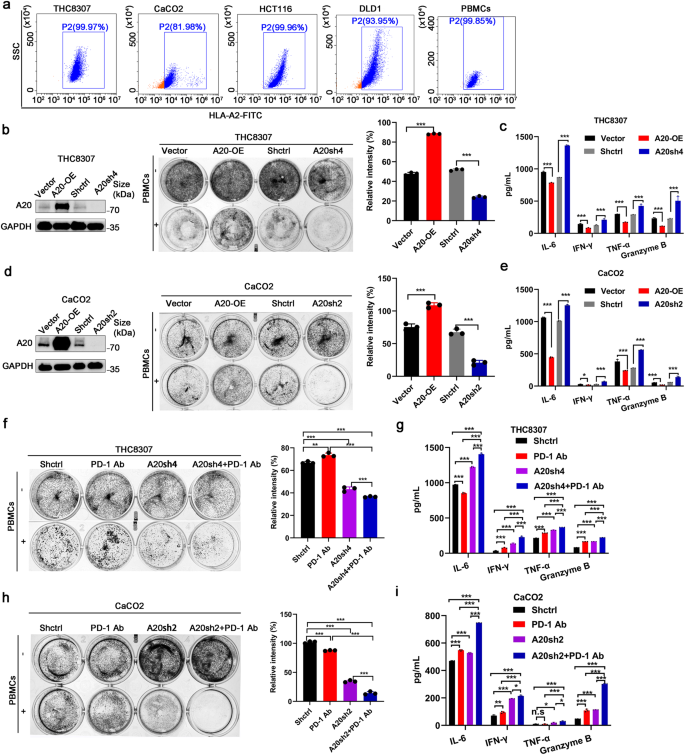
A20抑制体外抗肿瘤免疫反应(图源自Signal Transduction and Targeted Therapy )
炎症与包括癌症在内的许多癌症的发展密切相关,并在调节癌症免疫反应中发挥着关键作用。A20,肿瘤坏死因子诱导蛋白3(TNFAIP3),是一种有效的抗炎酶,可以减弱细胞因子和病原体介导的炎症信号。A20由一个具有去泛素酶活性的N-末端卵巢肿瘤结构域(OTU)和七个共790个氨基酸残基的C-末端cys2-cys2锌指结构域(znfs)组成。这两个泛素编辑结构域的协同活性介导A20在NF-κB信号传导中的负调控作用。因此,A20基因的多态性或遗传缺陷可能通过激活促炎性NF-κB信号传导而导致多种自身免疫性疾病的发生和发展。
该研究揭示了CRC中炎症分子A20和“吃我”信号之间的新串扰,为选择合适的ICIs患者提供了新的生物标志物,并为CRC提供了潜在的ICI联合治疗策略。在此研究中,癌症细胞中A20的上调通过降低CRT蛋白的细胞表面表达和以STC1-CRT依赖的方式促进肿瘤免疫逃避来促进CRC的生长。A20的高表达与PD-1抑制剂治疗的不良反应有关,与CRC患者的生存率呈负相关。基因过表达和敲除实验表明,A20在体外和体内促进肿瘤免疫逃避并诱导对ICIs的耐药性。该研究的结果表明,A20是细胞内“吃我”的信号阻断剂。靶向A20是癌症治疗中克服ICI耐药性的一种新方法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


