“万金油”胺碘酮新用 或可有效抵御乳腺癌转移
来源:生物探索 2022-02-06 09:39
据世界卫生组织国际癌症研究机构统计数据显示, 2020年,乳腺癌已取代肺癌成为全球第一大癌症 。 根据不同因素,乳腺癌主要治疗方式有手术、化疗、放疗、激素疗法以及靶向疗法。 因乳腺癌发现时多为中晚期,治疗难度已非常大,若是又发生转移,治愈则会难上加难。美国塔夫茨大学生物医学工程学院研究团队发布了一项题为“Potassium channel-driven bi
据世界卫生组织国际癌症研究机构统计数据显示, 2020年,乳腺癌已取代肺癌成为全球第一大癌症 。 根据不同因素,乳腺癌主要治疗方式有手术、化疗、放疗、激素疗法以及靶向疗法。 因乳腺癌发现时多为中晚期,治疗难度已非常大,若是又发生转移,治愈则会难上加难。
美国塔夫茨大学生物医学工程学院研究团队发布了一项题为“Potassium channel-driven bioelectric signalling regulates metastasis in triple-negative breast cancer”的研究,该 研究发现通过操控钾离子通道的表达改变三阴性乳腺癌(Triple-negative Breast Cancer,TNBC)细胞的静息电位(Resting Membrane Potential,RMP)会促进体外侵袭、体内肿瘤生长和转移,并伴有细胞粘附有关基因表达变化,但可利用胺碘酮(一种抗心律失常药物)阻断TNBC细胞的内源性 K+ 通道来逆转RMP状态,减少乳腺癌细胞体外迁移和体内转移 。
目前还没有直接针对癌症入侵细胞的临床可用疗法,因此,转移仍然是癌症患者死亡的主要原因。 而三阴性乳腺癌亚型约占所有乳腺癌病例的15%,被称为“乳腺癌中的绝症”。 与其他亚型相比,其5年预后较差、转移可能性高、总生存期缩短。 此外,其激素受体阴性,对激素药物不敏感,因此迫切需要更有效的治疗方法。
细胞的静息电位,即质膜上的净离子电流为零的膜电位,通常保持在一个负值。 静息电位取决于最丰富离子( K+ 、Na+ 、Ca2+和Cl- ) 的浓度梯度、膜对这些离子的渗透性、以及离子通道的表达和活性。 由于这些因素变化,细胞的RMP可以表现为超极化(更负)或去极化(更正)。 癌细胞的生物电特性与正常细胞有很大的不同: 癌细胞RMP更加去极化,且离子通道表达和活性失调。 先前研究已经证明,Na+和 K+通道活性可以调节乳腺癌的迁移、入侵和转移。
虽然已知 K+ 通道活性调节正常细胞的RMP,但这一点尚未在TNBC细胞中得以证实。 因此,为了确定哪些离子在TNBC细胞的RMP中占主导地位,研究人员将人类乳腺癌细胞系(LM2、MDA-MB-231、SUM159、MDA-MB-468和BT20)和永生化的正常乳腺上皮MCF10A细胞放在一系列细胞外溶液中。 实验中观察到,与生理K+浓度相比,用不断增加的K+细胞外浓度培养细胞会导致转移性LM2、MDA-MB-231、SUM159和MDA-MB-468的细胞群明显去极化,但对转移性差的BT20或健康上皮系MCF10A则没有影响。在Na+或Cl-溶液中培养则对任何系的RMP都没有影响。
有趣的是,RMP增加也与细胞系的转移潜力有关。 在细胞外K+浓度增加的情况下,转移潜力大的细胞系比转移潜力小或健康的MCF10As有相对更大的去极化。这表明,K+通道在人类乳腺癌肿瘤中是上调的, TNBC细胞的RMP是由K+通道活动调节 。
为了研究K+电导以及由此引起的RMP变化对乳腺癌细胞转移的潜在影响,研究人员采用MDA-MB-231和MDA-MB468细胞系表达两种不同类型的绿色荧光蛋白标记的K+通道,结果表明,相对于MCF10A健康乳腺上皮细胞,上述细胞系的RMP明显更负。 研究人员也研究了K+通道驱动的超极化对3D细胞侵袭的影响,结果表明K+通道驱动的RMP超极化促进了TNBC细胞迁移和侵袭。 小鼠异种移植模型研究也表明K+通道驱动的RMP超极化促进体外TNBC细胞迁移和侵袭,体内肿瘤生长和转移。
在确定K+通道过表达和超极化会引起TNBC细胞系的深刻表型变化后,研究人员试图进一步确定其细胞迁移机制。K+通道已被证明通过调节细胞内Ca2+水平来驱动细胞迁移,因此研究人员首先采用罗丹明(钙敏感荧光染料)进行实验,实验发现K+诱导的TNBC细胞超极化并未通过Ca2+信号驱动迁移。 为了确定基因表达变化是否可以解释上述结果,研究人员又进行了RNA测序,差异表达分析显示,通道过度表达系中差异表达的基因数量显着;主成分确定细胞RMP的变化对基因表达有显着影响。总而言之,K+通道驱动的RMP超极化引起基因表达显着变化,上调细胞黏附通路。观察到的细胞粘附相关基因上调表明,K+通道过表达可能改变TNBC细胞的粘附和形态,进一步研究证实K+通道驱动的RMP超极化与细胞形状和粘着信号的变化有关。
钙粘蛋白-11已被证明可驱动上皮癌转移,特别是在乳腺癌中,钙粘蛋白-11与细胞迁移、上皮间质转化和促进转移有关。先前的数据收集中发现,CDH11 mRNA水平与38.5%(20/52)的TNBC患者K+通道中mRNA水平呈正相关,因此,研究人员选择研究钙粘蛋白-11在K+通道中的驱动作用。为了确定CDH11基因的表达增加是否与钙粘蛋白-11表达增加相对应,团队也对K+过表达的231细胞系中的钙粘蛋白-11进行了量化研究。接下来,研究人员用先前在乳腺癌细胞中使用的siRNA诱导CDH11基因敲除,并在MDA-MB-231 K+通道过度表达中测量对细胞迁移和粘附的影响,结果表明超极化细胞的2D迁移和3D侵袭增加是由钙粘蛋白-11和MAPK信号驱动的。
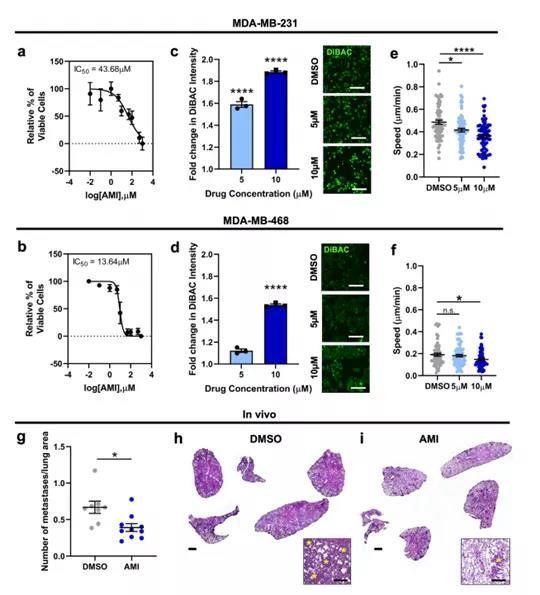
为了确定靶向乳腺癌细胞的RMP治疗转移性疾病的可行性,研究人员研究了K+通道阻滞剂对细胞侵袭和转移的影响,选择四种已知可阻断K+通道并与其他肿瘤抗癌作用相关的临床可用药物: 胺碘酮、卡维地洛、丙咪嗪和硫里哒嗪。经过筛选后,胺碘酮凭借较大的去极化作用入选后续实验。胺碘酮是III类抗心律失常药物,已知可阻断电压门控和内向整流钾通道,并已被证明可提高肝细胞癌患者生存率。
实验中,MDA-MB-231细胞在两种浓度下的2D细胞迁移显着减少,MDA-MB-468细胞在10 μM浓度下的2D细胞迁移显着减少。有趣的是,胺碘酮还影响了钙粘蛋白-11的表达水平。进一步研究发现,10 μM胺碘酮处理的MDA-MB-231和MDA-MB-468细胞增殖减少。在TNBC小鼠模型中,使用K+通道阻滞剂胺碘酮可以从药理学角度靶向乳腺癌细胞的生物电状态,减少乳腺癌细胞迁移和肺转移 。
胺碘酮的抗癌作用可通过心脏适应症使用的同等标准治疗水平更低的剂量来实现,从而避免先前报道的非靶向毒性。离子通道阻滞剂,如胺碘酮,由于其普遍性和已知的安全性,为药物再利用提供了丰富资源。 不过,研究人员也表示,虽然确实在MDA-MB-231和MDA-MB-468细胞中观察到较高浓度的胺碘酮在体外具有抗增殖作用,但除了阻断外向钾通道外,据报道胺碘酮在某些条件下还能阻断心肌细胞的内向钠和钙电流,因此不能完全将观察到的MDA-MB-231细胞的去极化现象归因于单独的钾通道阻断。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


