医保和药企的“创新价值”觉醒
来源:医药魔方 2023-07-05 11:00
自2018年国家医保局成立,每年一度的医保谈判和医保目录调整就成为医保购买“创新”的重要时间。历经五年探索,医保准入产品的
自2018年国家医保局成立,每年一度的医保谈判和医保目录调整就成为医保购买“创新”的重要时间。历经五年探索,医保准入产品的数量和领域分布也体现了医保购买创新的成绩。2015-2022年6月共有441个获批上市的创新药,其中260个进入国家医保目录(59%),抗肿瘤和抗感染的药品绝对数量最多。相比于十年前,创新药获批的数量和准入医保目录的数量的占比都有巨大提升。
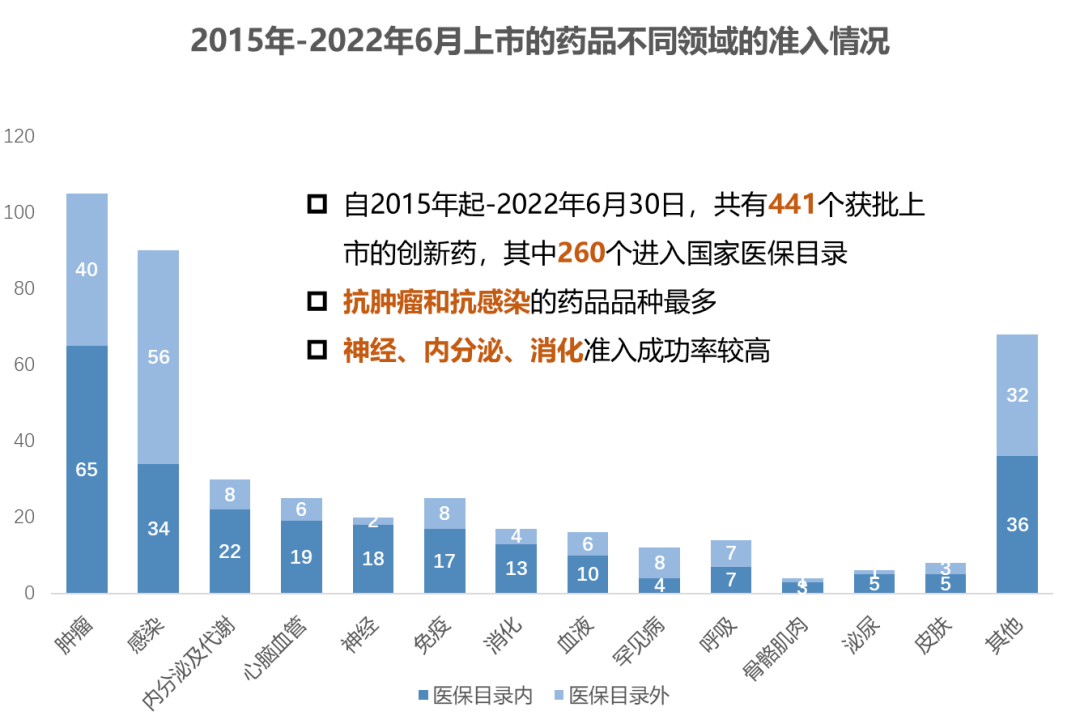
数据来源:医药魔方(截至2022年6月30日)
虽然与英国、德国、日本通过国家医保和社会医保实现近100%医保准入率相比差距甚远,但是此类方式确实在缓解医保基金压力、患者药品可及性和促进市场创新等目的之间达到了平衡。
着眼于未来更合理的准入机制,笔者团队在近期举行的2023年国际药物信息大会(DIA)的“新药研发与市场准入”模块上也提出中国未来创新药的购买应呈现“多方购买多种价值”的局面。
医保采取药物经济学评估的方式评估效益和控制定价,为真正的好药买单,此举是价值准入(value-based assessment)的起点。目前医保评估“价值”的维度包括安全、有效、经济、创新和公平,要求企业在提交申报材料时详细说明这五个方面的信息。安全和有效证据来源于临床试验和真实世界数据,经济性来源于经济学评价,这三者共同形成初步的定价,而创新和公平并没有标准的量化方式,只能作为价格调整因素。
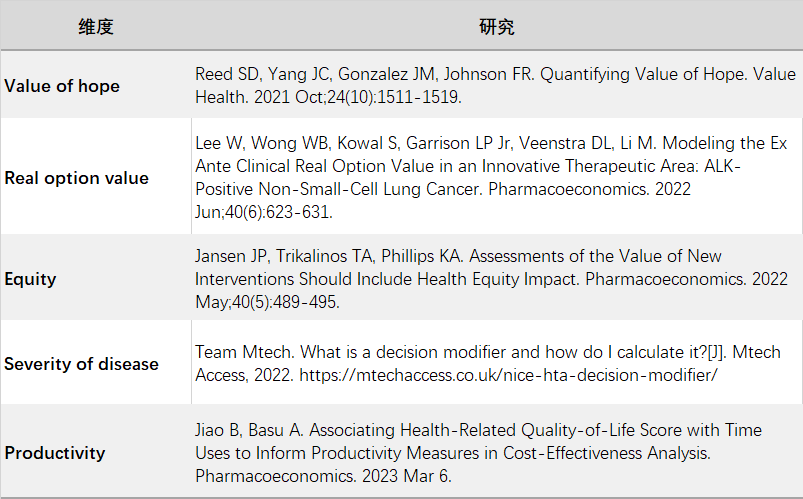
事实上,不同机构以及各国学者都提出了价值评估框架,例如ESMO的金字塔、ASCO的评分系统、ISPOR的价值花,这些框架涉及到的维度也不尽相同,可以被吸收汲取纳入到中国医保价值准入评估的维度还有很多,例如NICE根据疾病严重程度对阈值进行调整,恩沃利单抗作为首个皮下注射的PD-L1单抗具有更高的技术适宜性和支付意愿,医保在努力辨别和设定机制将这些价值融合到定价中来,但出于医保“保基本”的定位,这些价值并不可能完全被医保覆盖。更体现技术个性和患者个性的“创新价值”需要被额外的支付方覆盖。
我国的医保筹资制度和德国、日本的社会医保比较相近,因此除却基本医疗保险之外,付费的主体还包括商保和自费。目前国家在大力推行商保,例如惠民保、高端医疗险等,承担高端医疗需求,推动中国医药行业的转型。惠民保作为我国推进多层次医疗保障体系,社商融合的起点,惠民保准入的价值评估探索可以参考美国medicare模式并成为中国商保价值准入的尝试。各种保险应该如何分工为多种价值付费,商保应该如何建立价值准入机制并侧重哪些价值,目前国际上并没有完美答案,需要根据中国的情况自我探索,但“多方购买多种价值”是减轻患者负担、减轻医保资金负担、良性推动保险制度发展的可行途径。
此局面的形成不仅需要保险市场和筹资政府的拥抱开放的价值观,也需要学界对于价值定义、测量方法、价值组合方法、准入机制标准化进行更深一步的研究,这其中药物经济学作为价值评估的原生学科将发挥重要的作用。药物经济学本身是基于临床产出和投入成本研究价值的学科,具备良好的理论基础和研究方法在更广泛的维度中研究价值。药经学者已经产出和正在研究的与更广泛的价值维度相关的成果能证明此观点。
未来中国会逐渐形成“多方购买多种价值”的局势,并且价值评估日益规范化制度化,对于企业来说,成功准入和实现盈利的难度又一次提升。有不少企业已经洞察到这一变化,在此次DIA大会上聚集了诸多研发的客户群体,纷纷提及在研发的早期选择靶点、选择适应症、写说明书等决策环节会影响后期的市场布局和策略,因此需要市场和准入的同事参与,否则很有可能出现“上市不盈利”的情况。笔者团队结合多年的研究经验针对企业的这一痛点,提出“双筛选”和“全生命周期价值判断”。
随着创新药赛道的拥挤和评估体系的规范化,创新药并非仅仅实现安全和有效性就能够实现商业化的成功,中国存在太多“好药卖的烂,烂药卖得好”的情况。排除一些“野路子”的营销手段,决定药品成功的维度还包括患者获益、企业盈利、社会受益。临床试验完成自然筛选,商业化价值判断完成社会筛选,组成“双筛选”,共同构成一个产品的成功。而商业化价值判断需要贯穿药品的全生命周期,将产品价值内化到企业本身,提早进行价值判断,及时调整早期决策,以终为始。
总结为,借助市场洞察、投入-回报模型、循证医学、药物经济学、预算影响分析等技术手段,在靶点发现、研发早期、临床、上市后准入、退市等药品全生命周期各环节,预测性评估药耗、器械等产品的商业价值、产业价值、临床价值、政策价值、社会价值,为企业制定licence-in/out、BD、临床试验、注册申报、市场准入等策略提供决策支持。
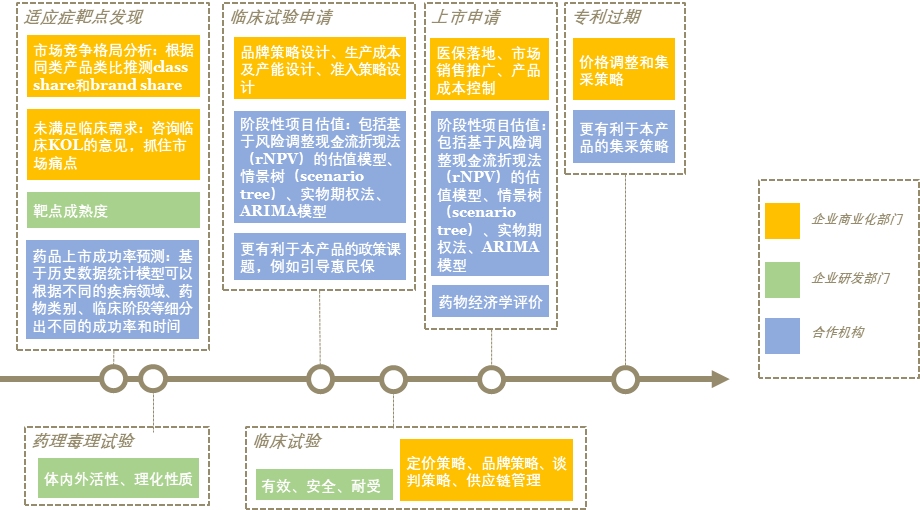
以具体案例来说明全生命周期中如何提早做价值判断。①临床前价值判断最基本的是市场竞争和未满足临床需求评估,根据《中国新药注册临床试验进展年度报告(2021)年)》披露,当年临床登记临床试验中靶点为PD-1的数量为71,四个靶点PD-1、PD-L1、HER2和EGFR的适应症全部集中在抗肿瘤领域,但目前上市的PD-1产品已让后来者无甚盈利空间。更多一些的价值包括科学溢出效应等产业价值,例如CAR-T技术。②临床阶段价值除了商业价值之外,还需要通过药物经济学、预算影响分析、投入回报模型来预测长期的临床获益、准入医保可能性、成本回收时间等数据,根据结果及时调整临床的决策,信迪利单抗和特瑞普利单抗在医保谈判中的竞争和最后的成败是证明此的较好案例。③上市后价值判断除了上述提及的纬度之外,还包括生产力节约、依从性提升、适宜性改善、公平性提升等可以对价格进行调整的维度,恩沃利单抗改变技术适宜性,需要做患者调研证明值得更高的支付水平,是上市后价值判断工作之一。
以上提及的“双筛选”和“全生命周期价值判断”是学术界可以和企业合作做出的贡献,基本思路是以终为始,减少临床资源消耗,提高全生命周期各阶段转化成功率。众多创新药企不仅面临严峻的市场竞争,更是被公司内部的决策冲突消耗得筋疲力尽,归根溯源,“人治”与“制治”之争。各大经久不衰的跨国药企内部都有严格SOP管理机制,但是中国化存在严重障碍,需要有创新药企“打样”,实践摸索出一套从研发到临床到上市的适合中国创新药企的内部决策机制,借助学界的“价值判断”的力量,提高临床前到临床、临床到上市的转化率,并制定一套评估企业效益产出,成本消耗的评估模型。
总之,多方购买多种价值是未来准入的新模式,企业需适应价值评估科学化,将价值判断提早介入研发,能够帮助企业节省临床资源和提高产品成功率。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


