Molecular Cancer: 科学家们揭示了CDK9i诱导表观遗传格局的重新编程
来源:生物谷原创 2023-04-17 16:37
细胞周期蛋白依赖性激酶(CDK)家族在调节细胞周期进程(如CDK1/2/4/6)和RNA转录(如CDK7/8/9/11)中起着不可或缺的作用。
细胞周期蛋白依赖性激酶(CDK)家族在调节细胞周期进程(如CDK1/2/4/6)和RNA转录(如CDK7/8/9/11)中起着不可或缺的作用。由于染色体区域或基因扩增易位而导致的CDKs表达失调与肿瘤的发生有关,使CDKs成为有吸引力的治疗靶点。
PAN-CDK抑制剂(例如,地奈西利和黄烷醇)的开发已经停滞不前,部分原因是治疗指数太窄。与此同时,越来越多的证据表明,CDK9,一种转录CDK,是高周转率癌基因的关键驱动因素,特别是在依赖MYC的癌症中。

图片来源:https://doi.org/10.1186/s12943-023-01762-6
近日,来自美国希望之城国家医疗中心的研究者们在Molecular Cancer杂志上发表了题为“CDK9 inhibition induces epigenetic reprogramming revealing strategies to circumvent resistance in lymphoma”的文章,该研究揭示了CDK9i诱导表观遗传格局的重新编程,并且超级增强子驱动的选择癌基因的恢复可能有助于对CDK9i的抗性。PIM和PI3K是在DLBCL的异质性环境中规避对CDK9i耐药的潜在靶点。
弥漫性大B细胞淋巴瘤(DLBCL)表现出明显的遗传异质性,导致耐药,迫切需要开发新的治疗方法。细胞周期蛋白依赖性激酶(CDK)的药物抑制剂在DLBCL中显示出临床前的活性,但许多药物在临床开发中停滞不前。
在本研究中,研究者发现CDK9的选择性抑制剂AZD4573抑制了DLBCL细胞的生长。CDK9抑制(CDK9i)导致转录组和蛋白质组的快速变化,多种癌蛋白(如MYC、Mcl-1、JunB、PIM3)的下调,以及磷酸肌苷-3激酶(PI3K)和衰老途径的解除调节。
在RNAPII暂停导致的最初转录抑制之后,研究者观察到包括MYC和PIM3在内的几个癌基因的转录恢复。ATAC-Seq和CHIP-Seq实验表明,CDK9i通过染色质可及性的双向改变诱导表观遗传重塑,抑制启动子的激活,并导致超级增强子景观的持续重新编程。CRISPR文库筛选表明,介体复合体中的SE相关基因以及AKT1对CDK9i具有抗性。
与此一致的是,sgRNA介导的MED12基因敲除使细胞对CDK9i敏感。根据机制发现,研究者将AZD4573与PIM激酶或PI3K抑制剂联合使用。这两种药物在体外均能抑制DLBCL和原代淋巴瘤细胞的增殖和诱导其凋亡,并能延缓DLBCL体内移植小鼠的肿瘤进展和延长其存活时间。
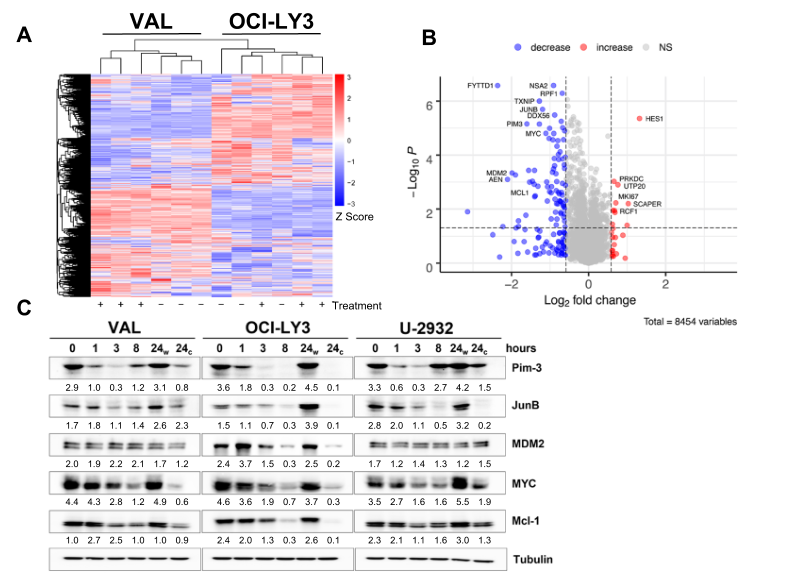
CDK9抑制对启动子和增强子格局的重新编程
图片来源:https://doi.org/10.1186/s12943-023-01762-6
研究者发现,CDK9抑制(CDK9i)迅速耗尽淋巴细胞中的癌基因,随后不可避免地在转录水平上恢复。CDK9i诱导表观遗传重塑,并重新编程超级增强子景观。对CDK9i的耐药性可以通过破坏超级增强子相关蛋白(BRD4,中介复合体)或靶向PIM和PI3K/ATK通路来规避。本研究的发现对这类药物的临床开发具有一定的指导意义。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


