上海交大房静远团队:具核梭杆菌是如何诱导结直肠癌的?在肠癌的诊疗中有哪些应用价值?
来源:奇点糕 2022-11-22 09:20
结直肠癌(CRC)的发病率和死亡率均已上升为全球第三[1,2],癌症的发生和发展是遗传因素和环境因素共同驱动的,CRC也不例外,在环境因素中,肠道微生物是一种特殊的环境危险因素[3]。
结直肠癌(CRC)的发病率和死亡率均已上升为全球第三[1,2],癌症的发生和发展是遗传因素和环境因素共同驱动的,CRC也不例外,在环境因素中,肠道微生物是一种特殊的环境危险因素[3]。
2012年,两项CRC微生物组的基因组分析研究同时报告,一种常见的口腔厌氧细菌——具核梭杆菌在肿瘤组织中富集[4,5]。具核梭杆菌是一种机会性致病菌,过多的具核梭杆菌能够刺激牙龈卟啉单胞菌,破坏宿主稳态,诱发牙周炎[6]。
在肿瘤组织中被发现后,研究人员对其开展了一系列后续研究,结果显示,具核梭杆菌参与了CRC的发生、发展和化疗耐药性[7,8]。
作为机会性致病菌和肿瘤相关细菌,具核梭杆菌近年来一直是交叉领域的前沿关注重点。因此,来自上海交通大学医学院的房静远教授团队在Trends in Microbiology杂志上发表综述文章,介绍了具核梭杆菌在CRC中的致病机制及作为微生物标志物和治疗靶点的潜力[9]。
越来越多的研究表明,具核梭杆菌参与CRC进展的多个阶段,在这个部分里,综述回顾了目前研究所发现的,具核梭杆菌在CRC发生和发展中所发挥的作用。
具核梭杆菌促进了CRC的增殖和代谢
在APCMin/+CRC小鼠模型中,经口移植具核梭杆菌可以促进腺癌、腺瘤和小肠异常隐窝[10],进一步的研究表明,具核梭杆菌可以通过刺激CRC细胞的增殖和代谢来促进肿瘤的发生[7,11]。
具核梭杆菌的毒力因子梭杆菌黏附素A(FadA)能够与肠上皮细胞的E-钙黏蛋白结合,触发Wnt-β连环蛋白通路,作用于细胞周期蛋白D1,促进细胞增殖[7]。
具核梭杆菌作为革兰氏阴性菌,其细胞壁成分——脂多糖(LPS)也能够通过Toll样受体4(TLR4)/磷酸化p21活化激酶1(PAK1)级联触发β连环蛋白通路。不但如此,LPS与TLR4结合后还能够通过MYD88激活NF-κB,并增加miRNA-21的表达,降低RASA1的表达,刺激RAS-MAPK通路,最终诱导细胞S期的积累,以此增强CRC细胞增殖[12]。
从代谢方面来看,具核梭杆菌能够上调CRC细胞中ENO1和ANGPTL4基因的H3K27ac,激活CRC细胞的糖酵解和癌变[11,13]。
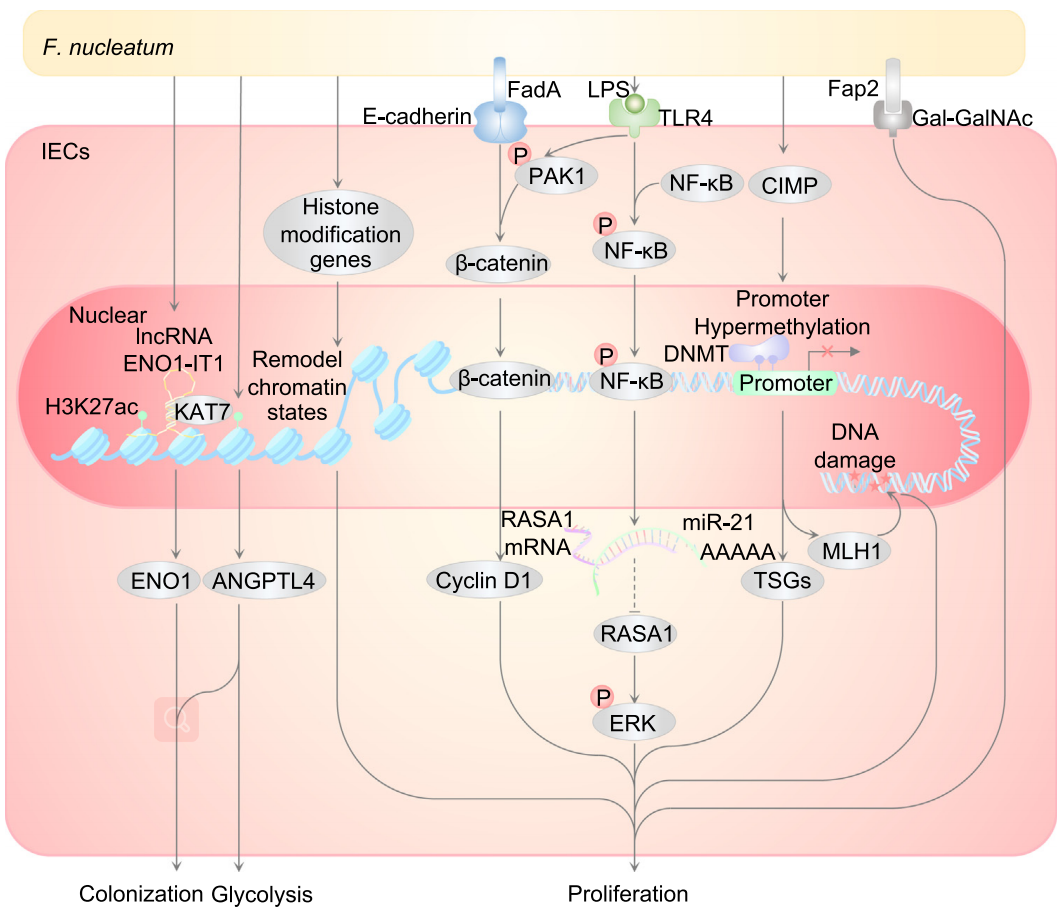
具核梭杆菌在CRC发生发展中的潜在分子机制
具核梭杆菌重塑造炎性肿瘤免疫微环境
2013年的一项研究[10]首次报告了具核梭杆菌具有调节促肿瘤炎症微环境的能力。具核梭杆菌可以激活NF-κB通路,上调促炎因子(COX-2、TNF、IL-6、IL-8和IL-1β),招募骨髓源性免疫细胞,如骨髓源性抑制细胞(MDSC)、肿瘤相关中性粒细胞、肿瘤相关巨噬细胞(TAM)和树突状细胞,从而重编程免疫微环境,促进肿瘤进展。
另外,梭杆菌Fap2(一种凝集素)可以与肿瘤过表达的Gal-GalNAc结合,介导具核梭杆菌在CRC肿瘤中的定植和侵袭,诱导IL-8和CXCL1的分泌,这些促炎因子也可以招募周围的免疫细胞,进一步分泌CXCL2、CCL3和TNF-α等促炎因子,塑造炎性肿瘤微环境[14,15]。
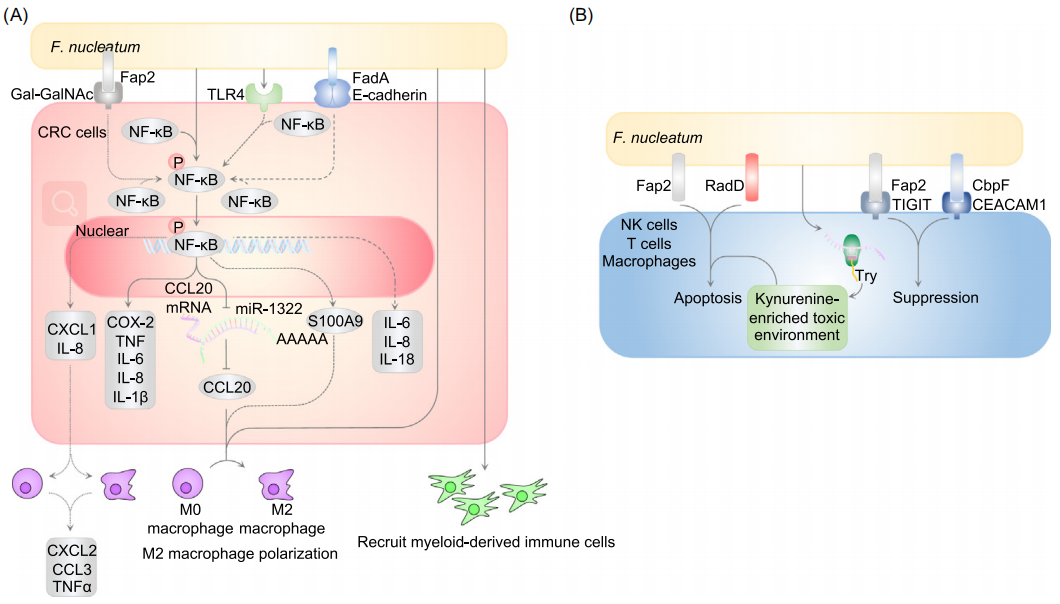
具核梭杆菌重塑CRC和免疫微环境
具核梭杆菌抑制抗癌免疫反应
多项研究表明,具核梭杆菌在CRC组织中富集,并且与肿瘤浸润淋巴细胞(TIL)数量呈负相关,抑制了抗肿瘤免疫反应。除此之外,还有MDSC和M2样TAM,MDSC是一种具有很强的免疫抑制活性的髓系细胞,也是肿瘤微环境的重要组成部分,M2样TAM具有促癌功能,具核梭杆菌以TLR4依赖性方式触发巨噬细胞的M2方向极化,刺激CRC增殖[16,17]。
不但如此,具核梭杆菌还能够通过Fap2与TIGIT结合,抑制NK细胞的肿瘤杀伤功能[18],或者通过Fap2诱导淋巴细胞凋亡,肿瘤增长[19,20]。
具核梭杆菌诱导遗传和表观遗传变化
除了常见的特定基因TP53、KRAS和Apc的突变,表观遗传改变,包括启动子DNA和RNA甲基化、组蛋白甲基化和乙酰化,也是CRC的常见诱因。越来越多的研究表明,具核梭杆菌与CRC遗传和表观遗传之间存在关联。
流行病学相关性研究表明,具核梭杆菌水平的增加促进了CRC的微卫星不稳定性(MSI)、CpG岛甲基化表型(CIMP)和基因组突变[21,22]。与低水平的CIMP相比,典型的高水平CIMP CRC与MSI有关,由错配修复基因MLH1的表观遗传沉默介导[23,24]。
随后的研究通过对CRC患者的粘膜或粪便菌群16S rRNA测序,证实了具核梭杆菌水平升高与结直肠近端肿瘤、CIMP和MSI的关联[25]。在MSI高的CRC中,具核梭杆菌的富集与CDKN2A的启动子CpG岛高甲基化有关[26]。
除甲基化外,组蛋白乙酰化也发挥着重要作用。具核梭杆菌激活长非编码RNA ENO1-IT1-赖氨酸乙酰转移酶7轴,刺激组蛋白H3赖氨酸27和乙酰化和ENO1表达,继而诱导CRC的糖酵解[11]。此外,存在具核梭杆菌的CRC肿瘤中还观察到了H3K27ac诱导的ANGPTL4过表达[13]。
具核梭杆菌促进CRC的转移和化疗耐药
CRC中过多的梭杆菌与局部淋巴结转移和远端转移呈正相关。具核梭杆菌通过TLR4/KEAP1/核因子和NRF2通路激活细胞色素P450(CYP2J2)/12,13-EPOME轴,刺激上皮-间充质转化(EMT)和转移[27]。另外,具核梭杆菌还能够激活NF-κB通路,增加lncKRT7-AS/KRT7,促进CRC转移[28]。
目前,化疗药物5-氟尿嘧啶(5-FU)和奥沙利铂被广泛应用于治疗CRC。然而,化疗耐药一直是CRC复发和患者预后不良的主要原因。
研究人员在化疗后复发的CRC患者中检测到了具核梭杆菌的富集,它们可以有选择性地减少miR-18a*和miR-4802的水平,激活自噬,从而诱导化疗耐药[8]。另外,晚期CRC患者在接受根治性手术后,使用基于5-FU的标准辅助化疗时,具核梭杆菌的丰度和耐药性有关[29]。
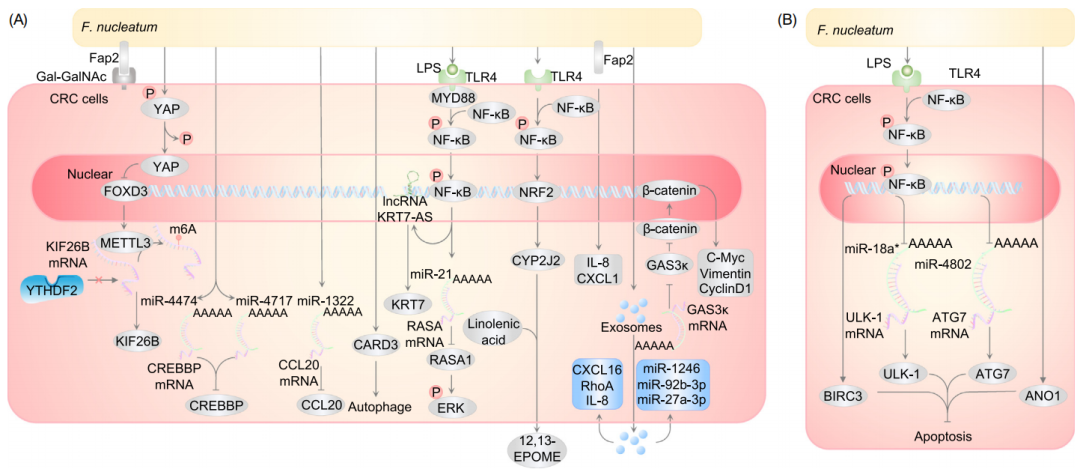
具核梭杆菌促进CRC转移和化疗耐药的潜在机制
在接下来的这个部分里,综述回顾了具核梭杆菌在CRC中的潜在临床价值。
预警、诊断和预后预测的标志物
生物标志物有助于能够帮助医生在癌前病变阶段或癌症早期进行有效地筛查,从而降低CRC相关死亡率。由于在癌前病变和肿瘤组织中都观察到了具核梭杆菌的富集,并且其丰度随CRC的病理分期而升高,具核梭杆菌或许能够作为高危人群和CRC早期预警的生物标志物。
基于此,下一步需要讨论的就是量化检测具核梭杆菌的方法。一项Meta分析研究表明,定量PCR可以检测CRC癌前病变和CRC患者粪便中富集的具核梭杆菌[30],在粪便潜血检测(FOBT)的基础上加入定量PCR可以提高FOBT的特异性和敏感性[31]。
除定量PCR外,新的基于抗体的检测方法可能也有助于CRC筛查,例如具核梭杆菌的IgA和IgG抗体,研究表明,CRC患者的具核梭杆菌IgA和IgG抗体的水平高于匹配的对照组。结合CEA和CA 19-9,抗具核梭杆菌IgA可能能够更有效地检测早期CRC[32]。
在几个独立队列中,研究人员发现,具核梭杆菌丰度与CRC患者的总生存期之间存在显著的负相关关系,而接受手术的患者,高丰度的具核梭杆菌同样与较差的预后有关,这些发现都表明,具核梭杆菌有潜力用于CRC的预后标志物。
结直肠癌的治疗靶点
基于具核梭杆菌在CRC发生发展中的重要作用,具核梭杆菌被认为可作为CRC的治疗靶点之一。抗生素——甲硝唑可以消除具核梭杆菌,在异种移植的CRC小鼠中有效缩小了肿瘤体积,非甾体抗炎药物——阿司匹林也可以消除具核梭杆菌,它在CRC中的预防作用或许就是部分由此介导的。
既然抗生素可以,那么比抗生素能够更精准地靶向单一细菌的噬菌体或许也可以。研究表明,携带伊立替康纳米颗粒的噬菌体可以靶向定植了梭杆菌的肿瘤,调控肿瘤生长[33]。
一种由FadA与E-钙黏蛋白结合位点衍生的11-aa抑制肽被发现能够阻止具核梭杆菌在肿瘤中定植,以及与CRC细胞结合[7],同类药物还包括抗FadA单抗,但它们能否降低CRC发生率还是未知的,这类基于细菌毒力因子的疗法还需要更多的临床证据。
除此之外,粪菌移植,以及饮食、益生菌、益生元和后生元等可以调节肠道微生物组成的方法理论上都有辅助治疗CRC的潜力,但同样也需要更多更大规模的研究加以验证。
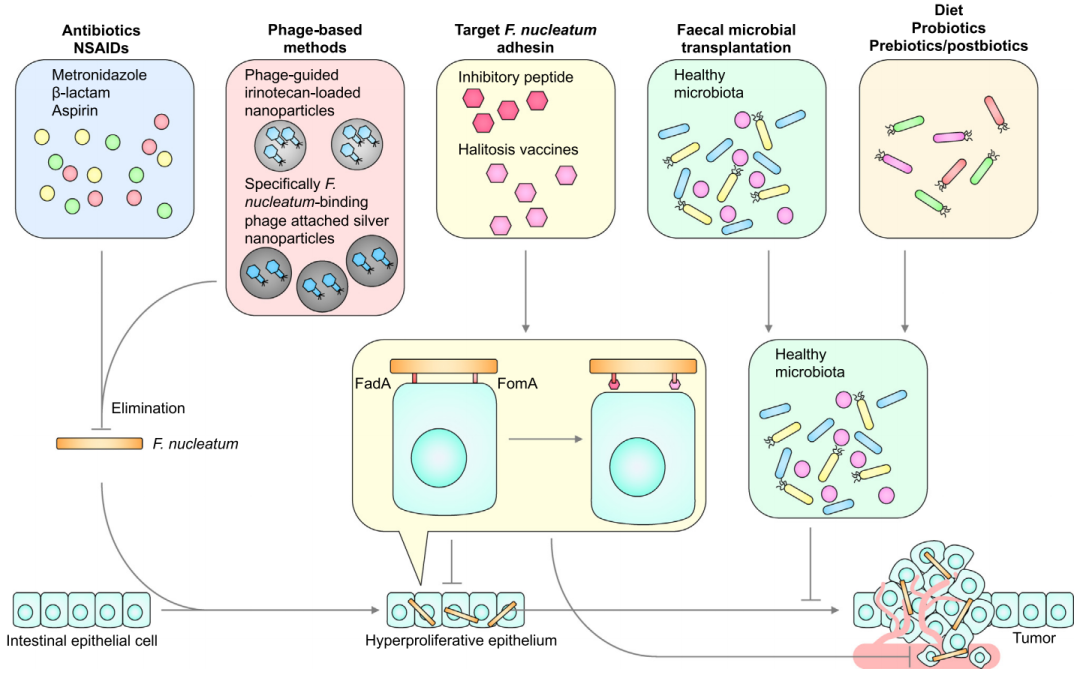
靶向具核梭杆菌的潜在治疗途径
具核梭杆菌是目前研究较多的一种癌症相关肠道微生物,无论是致病机制,还是作为生物标志物和治疗靶点的潜力。
然而,我们也要意识到,肠道微生物之间也存在复杂的相互作用,可能对具核梭杆菌与CRC的关系产生干扰,同时,考虑肿瘤特异性和患者个体差异,靶向具核梭杆菌的治疗能够起到怎样的效果仍然有很多的未知。像单独的肿瘤和肠道微生物研究一样,在这个交叉领域,我们还有很长的路要走。
参考文献:
[1] Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a cancer journal for clinicians, 2021, 71(3): 209-249.
[2] Siegel R L, et al. Cancer statistics, 2022[J]. CA: a cancer journal for clinicians, 2022, 72: 7-33.
[3] Coker O O, Nakatsu G, Dai R Z, et al. Enteric fungal microbiota dysbiosis and ecological alterations in colorectal cancer[J]. Gut, 2019, 68(4): 654-662.
[4] Kostic A D, Gevers D, Pedamallu C S, et al. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma[J]. Genome research, 2012, 22(2): 292-298.
[5] Castellarin M, Warren R L, Freeman J D, et al. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma[J]. Genome research, 2012, 22(2): 299-306.
[6] Lamont R J, Koo H, Hajishengallis G. The oral microbiota: dynamic communities and host interactions[J]. Nature reviews microbiology, 2018, 16(12): 745-759.
[7] Rubinstein M R, Wang X, Liu W, et al. Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesin[J]. Cell host & microbe, 2013, 14(2): 195-206.
[8] Yu T C, Guo F, Yu Y, et al. Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy[J]. Cell, 2017, 170(3): 548-563. e16.
[9] Wang N, Fang J Y. Fusobacterium nucleatum, a key pathogenic factor and microbial biomarker for colorectal cancer[J]. Trends in Microbiology, 2022.
[10] Kostic A D, Chun E, Robertson L, et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment[J]. Cell host & microbe, 2013, 14(2): 207-215.
[11] Hong J, Guo F, Lu S Y, et al. F. nucleatum targets lncRNA ENO1-IT1 to promote glycolysis and oncogenesis in colorectal cancer[J]. Gut, 2021, 70(11): 2123-2137.
[12] Yang Y, Weng W, Peng J, et al. Fusobacterium nucleatum increases proliferation of colorectal cancer cells and tumor development in mice by activating toll-like receptor 4 signaling to nuclear factor− κB, and up-regulating expression of microRNA-21[J]. Gastroenterology, 2017, 152(4): 851-866. e24.
[13] Zheng X, Liu R, Zhou C, et al. ANGPTL4-mediated promotion of glycolysis facilitates the colonization of fusobacterium nucleatum in colorectal cancer[J]. Cancer Res, 2021, 81(24): 6157-6170.
[14] Abed J, Emgård J E M, Zamir G, et al. Fap2 mediates Fusobacterium nucleatum colorectal adenocarcinoma enrichment by binding to tumor-expressed Gal-GalNAc[J]. Cell host & microbe, 2016, 20(2): 215-225.
[15] Casasanta M A, Yoo C C, Udayasuryan B, et al. Fusobacterium nucleatum host-cell binding and invasion induces IL-8 and CXCL1 secretion that drives colorectal cancer cell migration[J]. Science signaling, 2020, 13(641): eaba9157.
[16] Hu L, Liu Y, Kong X, et al. Fusobacterium nucleatum Facilitates M2 Macrophage Polarization and Colorectal Carcinoma Progression by Activating TLR4/NF-κ B/S100A9 Cascade[J]. Frontiers in immunology, 2021, 12: 658681.
[17] Chen T, Li Q, Wu J, et al. Fusobacterium nucleatum promotes M2 polarization of macrophages in the microenvironment of colorectal tumours via a TLR4-dependent mechanism[J]. Cancer Immunology, Immunotherapy, 2018, 67(10): 1635-1646.
[18] Gur C, Ibrahim Y, Isaacson B, et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack[J]. Immunity, 2015, 42(2): 344-355.
[19] Kaplan C W, Lux R, Huynh T, et al. Fusobacterium nucleatum apoptosis-inducing outer membrane protein[J]. Journal of dental research, 2005, 84(8): 700-704.
[20] Kaplan C W, Ma X, Paranjpe A, et al. Fusobacterium nucleatum outer membrane proteins Fap2 and RadD induce cell death in human lymphocytes[J]. Infection and immunity, 2010, 78(11): 4773-4778.
[21] Komiya Y, Shimomura Y, Higurashi T, et al. Patients with colorectal cancer have identical strains of Fusobacterium nucleatum in their colorectal cancer and oral cavity[J]. Gut, 2019, 68(7): 1335-1337.
[22] Mima K, Nishihara R, Qian Z R, et al. Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis[J]. Gut, 2016, 65(12): 1973-1980.
[23] Tahara T, Yamamoto E, Suzuki H, et al. Fusobacterium in colonic flora and molecular features of colorectal carcinoma[J]. Cancer research, 2014, 74(5): 1311-1318.
[24] Tahara T, Yamamoto E, Madireddi P, et al. Colorectal carcinomas with CpG island methylator phenotype 1 frequently contain mutations in chromatin regulators[J]. Gastroenterology, 2014, 146(2): 530-538. e5.
[25] Saito K, Koido S, Odamaki T, et al. Metagenomic analyses of the gut microbiota associated with colorectal adenoma[J]. PLoS One, 2019, 14(2): e0212406.
[26] Park H E, Kim J H, Cho N Y, et al. Intratumoral Fusobacterium nucleatum abundance correlates with macrophage infiltration and CDKN2A methylation in microsatellite-unstable colorectal carcinoma[J]. Virchows Archiv, 2017, 471(3): 329-336.
[27] Kong C, Yan X, Zhu Y, et al. Fusobacterium Nucleatum Promotes the Development of Colorectal Cancer by Activating a Cytochrome P450/Epoxyoctadecenoic Acid Axis via TLR4/Keap1/NRF2 SignalingFn Promotes Colorectal Cancer by CYP2J2/12, 13–EpOME Axis[J]. Cancer Research, 2021, 81(17): 4485-4498.
[28] Chen S, Su T, Zhang Y, et al. Fusobacterium nucleatum promotes colorectal cancer metastasis by modulating KRT7-AS/KRT7[J]. Gut microbes, 2020, 11(3): 511-525.
[29] Zhang S, Yang Y, Weng W, et al. Fusobacterium nucleatum promotes chemoresistance to 5-fluorouracil by upregulation of BIRC3 expression in colorectal cancer[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 1-13.
[30] Huang Q, Peng Y, Xie F. Fecal fusobacterium nucleatum for detecting colorectal cancer: a systematic review and meta-analysis[J]. The International journal of biological markers, 2018, 33(4): 345-352.
[31] Liang Q, Chiu J, Chen Y, et al. Fecal Bacteria Act as Novel Biomarkers for Noninvasive Diagnosis of Colorectal CancerFecal Bacterial Markers for Colorectal Cancer[J]. Clinical Cancer Research, 2017, 23(8): 2061-2070.
[32] Kurt M, Yumuk Z. Diagnostic accuracy of Fusobacterium nucleatum IgA and IgG ELISA test in colorectal cancer[J]. Scientific reports, 2021, 11(1): 1-6.
[33] Zheng D W, Dong X, Pan P, et al. Phage-guided modulation of the gut microbiota of mouse models of colorectal cancer augments their responses to chemotherapy[J]. Nature biomedical engineering, 2019, 3(9): 717-728.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


