铁死亡联合多种治疗手段研究获新进展
来源:上海交大 2021-05-21 20:45
癌症是一种十分凶险的疾病,由于其恶性程度高且预后差,极大地威胁人类健康,成为目前亟待解决的一大难题。目前,常规化疗药物及靶向药物大多通过诱导细胞凋亡抑制肿瘤进展。非凋亡相关的新型死亡方式的研究为癌症治疗提供了新的思路。铁死亡是近年来发现的一种新的程序性细胞死亡方式,在肿瘤的发生、发展及转移方面起到重要作用,铁死亡用于抗肿瘤治疗具有巨大的潜在优势。为了进一步提
癌症是一种十分凶险的疾病,由于其恶性程度高且预后差,极大地威胁人类健康,成为目前亟待解决的一大难题。目前,常规化疗药物及靶向药物大多通过诱导细胞凋亡抑制肿瘤进展。非凋亡相关的新型死亡方式的研究为癌症治疗提供了新的思路。铁死亡是近年来发现的一种新的程序性细胞死亡方式,在肿瘤的发生、发展及转移方面起到重要作用,铁死亡用于抗肿瘤治疗具有巨大的潜在优势。为了进一步提高铁死亡的抗肿瘤效果,研究铁死亡机制并联合其他治疗手段,开发多功能智能化的治疗系统具有十分重要的意义。近日,上海交通大学药学院沈琦课题组深入研究铁死亡机制,创新性地设计了纳米递药系统,探究铁死亡与焦亡,铁死亡与免疫联合治疗的抗肿瘤机制及效果。
由于癌症治疗中尚未充分研究铁死亡和焦亡联合疗法的潜力,沈琦课题组设计了一种双诱导纳米递送系统通过引起胞内铁诱导的ROS升高来实现铁死亡/焦亡双介导的抗癌作用。设计了一种双诱导纳米递送系统通过引起胞内铁诱导的ROS升高来实现铁死亡/焦亡双介导的抗癌作用。该纳米递送系统(Tf-LipoMof @ PL)是由转铁蛋白介导的pH 敏感脂质层包裹金属有机骨架(MOF)构成的,同时荜茇酰胺包载于MOF中。含铁的MOF被细胞吞噬后可以作为有效的铁供体。装饰在脂质层上的转铁蛋白不仅可以通过靶向作用促进纳米颗粒的内吞,而且可以促进胞内铁的吸收循环,进一步促进细胞内铁的富集,为铁死亡和焦亡的发生提供了先决条件。荜茇酰胺作为H2O2供体进一步促进了铁依赖性芬顿反应的发生并生成大量的ROS。结果表明,Tf-LipoMof @ PL可明显提高细胞内铁和ROS水平,并显示出了铁死亡和焦亡的双重诱导功效。该研究的体内实验也证明了Tf-LipoMof @ PL具有很好的抗肿瘤作用,进一步验证了铁死亡/焦亡双感应纳米系统可以作为一种有效的抗肿瘤方法。
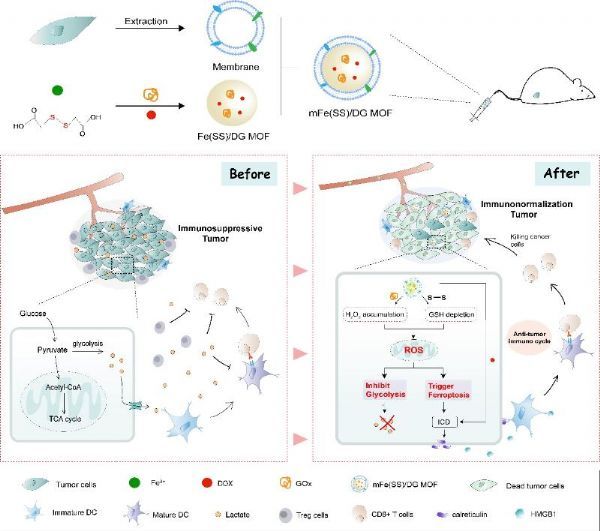
免疫治疗是当前肿瘤治疗领域的热点,沈琦课题组设计了多功能的纳米递药系统探究铁死亡联合免疫治疗的机制及抗肿瘤效果。低肿瘤免疫原性和免疫抑制微环境限制了抗肿瘤免疫治疗的效果,沈琦课题组针对该问题,构建了癌细胞膜包裹的负载葡萄糖氧化酶(GOx)和阿霉素的纳米金属有机框架(表示为mFe(SS)/DG)。得益于癌细胞膜的肿瘤同源靶向作用,该纳米递药系统有效地积累在肿瘤部位。mFe(SS)/DG结构中的Fe3+和带有二硫键的有机配体有效清除了肿瘤内的GSH,并下调了谷胱甘肽过氧化物4(GPX4)以诱导铁死亡的发生。GOx催化葡萄糖生成大量H2O2,以增强Fenton反应,导致肿瘤中的ROS累积,进而同时促进了铁死亡并抑制糖酵解。铁死亡与阿霉素联合可诱导免疫原性细胞死亡,并释放肿瘤抗原,增强肿瘤的免疫原性并启动抗肿瘤免疫。纳米递药系统通过抑制糖酵解减少肿瘤部位的乳酸,进而减弱肿瘤部位乳酸过量引起的免疫抑制,重塑免疫微环境以增强抗肿瘤免疫力。该智能仿生纳米纳米递药系统基于ROS-铁死亡-糖酵解调控肿瘤代谢,诱导铁死亡并联合免疫治疗,为基于铁死亡的抗肿瘤治疗提供了新的策略。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->