Science子刊:敲除这种抗病毒先天免疫系统,可改善癌症治疗
来源:生物世界 2023-12-06 16:23
干扰树突状细胞中的MAVS通路可能是一种有前途的癌症治疗策略,能够增强抗肿瘤免疫反应,特别是可以与放疗、免疫检查点阻断疗法等治疗相结合。
上海交通大学药学院邓刘福教授团队(博士生吴龄龄和洪小川为共同第一作者)在 Science Immunology 期刊发表了题为:Noncanonical MAVS signaling restrains dendritic cell-driven antitumor immunity by inhibiting IL-12 的研究论文。
该研究探索了线粒体抗病毒信号蛋白(MAVS)在肿瘤免疫中的作用,揭示了其与免疫反应的关系和潜在的治疗意义,发现了关闭部分先天免疫系统可以增强抗肿瘤活性。具体来说,与其在抗病毒反应中的作用相反,MAVS可支持肿瘤生长并阻碍抗肿瘤治疗。而敲除树突状细胞(DC)中的MAVS,能够促进抗肿瘤CD8+T细胞反应,而不影响其他免疫细胞群。此外,MAVS的缺失增加了肿瘤微环境和引流淋巴结中树突状细胞的白介素-12(IL-12)表达,该缺失似乎还影响了肿瘤抗原向引流淋巴结的运输,而不是影响抗原呈递。
这些发现表明,抑制树突状细胞(DC)中的MAVS信号通路,可以增强抗肿瘤免疫,并改善当前的癌症治疗方法(放疗、免疫检查点阻断疗法)。

线粒体抗病毒信号蛋白(MAVS)介导的胞质RNA感知在对抗病原体和肿瘤的免疫监测中发挥重要作用。在病毒RNA识别后,RIG-I和MDA5激活它们共享的接头蛋白MAVS,随后诱导产生I型干扰素(IFN-I)和其他促炎细胞因子。
肿瘤细胞内源性MAVS通路介导病毒拟态程序,诱导IFN-I信号转导,增强抗肿瘤免疫反应,并最终增加对免疫检查点阻断的敏感性。这种增强的肿瘤免疫原性已经在几种不同的表观遗传疗法中观察到。此外,最近的一些研究发现,MAVS具有独立于IFN-I反应的其他功能,例如,MAVS通过防止DNA损伤时p53-MDM2复合物的形成来维持p53蛋白的稳定性,并通过干扰素调节因子1(IRF1)-白介素15(IL-15)轴促进肠上皮内淋巴细胞的稳态。
尽管MAVS信号级联被认为是一个潜在的治疗靶点,可以重新激活T细胞炎症性肿瘤微环境,但宿主MAVS如何调控肿瘤免疫反应仍不清楚。
在这项研究中,研究团队通过基因工程小鼠模型发现,MAVS通路支持肿瘤生长并损害抗肿瘤免疫,而在树突状细胞(DC)中敲除MAVS,则会促进CD8+T细胞的抗肿瘤反应。
具体而言,敲除树突状细胞中的MAVS,以IFN-I非依赖性但IL-12依赖性的方式增强了CD8+T细胞。在机制上,RIG-I/MAVS级联的缺失激活了非经典的NF-κB通路,进而诱导树突状细胞产生IL-12,从而促进了CD8+T细胞和树突状细胞之间的交叉反应。此外,敲除MAVS的肿瘤小鼠模型对抗PD-L1免疫检查点阻断疗法和放疗更敏感,并促进了效应CD8+T细胞的维持。
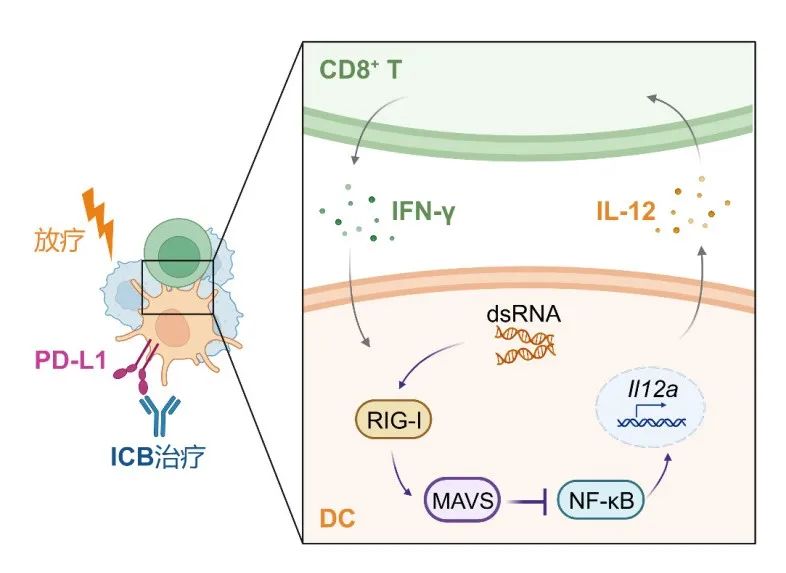
这些结果表明,干扰树突状细胞中的MAVS通路可能是一种有前途的癌症治疗策略,能够增强抗肿瘤免疫反应,特别是可以与放疗、免疫检查点阻断疗法等治疗相结合。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


