Cancer Cell: 肌成纤维细胞I型胶原蛋白缺陷促进胰腺癌的恶化
来源:本站原创 2021-04-13 21:01
胰腺导管腺癌(PDAC)的基质间质增生过程涉及I型胶原蛋白(Col1)的大量积累。但是,目前我们对Col1在PDAC恶化进程中的精确分子机制仍知之甚少。在最近发表在《Cancer Cell》杂志上的一项研究中,来自德克萨斯大学的Raghu Kalluri团队揭示了Col1在αSMA+肌成纤维细胞中的作用。
2021年4月13日讯/生物谷BIOON/---胰腺导管腺癌(PDAC)的基质间质增生过程涉及I型胶原蛋白(Col1)的大量积累。但是,目前我们对Col1在PDAC恶化进程中的精确分子机制仍知之甚少。在最近发表在《Cancer Cell》杂志上的一项研究中,来自德克萨斯大学的Raghu Kalluri团队揭示了Col1在αSMA+肌成纤维细胞中的作用。
(图片来源:www.cell.com)
I型胶原蛋白(Col1)是一种纤维状胶原蛋白,是人体中含量最高的蛋白质,尤其在骨骼,肌腱和皮肤中含量最高。Col1的基本功能单元是由两条α1链和一条α2链组成的异三聚体,它们在一起形成三螺旋结构。每个α链多肽都在细胞质中合成,并与其他两个α链结合以生成具有N末端和C末端前肽的三螺旋I型“原胶原”。随后,原胶原蛋白分子被分泌到细胞外,在此N端和C端前肽被前肽酶裂解,从而产生Col1的基本功能单元。 Col1三螺旋杆状分子彼此相互作用形成原纤维,并进一步交联形成大束纤维。
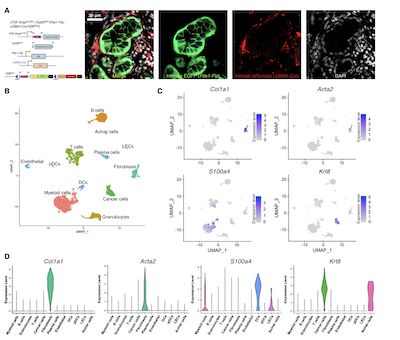
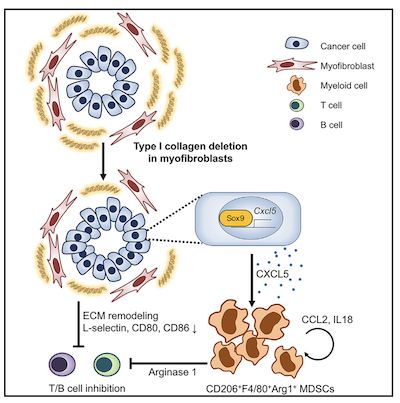
(图1,单细胞测序揭示肌成纤维细胞是PDAC小鼠肿瘤组织中Col1的主要来源)
在胚胎发育过程中,许多器官表达Col1,从而促进细胞迁移,分化和结构区室化的形成。系统性地删除Col1a1基因会导致胚胎致死。在器官纤维化和癌症等发病过程中,Col1在受影响的组织中大量积聚。已知肿瘤组织中的Col1会在癌细胞周围产生生物物理上的“刚性”微环境,从而通过Col1纤维“轨迹”促进细胞迁移,并促进细胞相互作用以诱导癌细胞的增殖和存活。
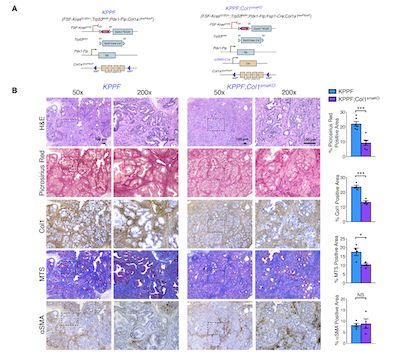
(图2,肌成纤维细胞中Col1缺失降低PDAC小鼠肿瘤组织中Col1的表达)
另一方面,研究表明Col1是胰腺导管腺癌(PDAC)相关肿瘤基质/微环境的主要成分。与PDAC相关的α-平滑肌肌动蛋白(αSMA)+ 肌成纤维细胞促进Col1的产生。尽管如此,Col1在PDAC的产生和发展中的确切功能仍然未知。

此前的研究使用了一系列不同的PDAC基因工程小鼠模型,例如KPC小鼠(LSL-KrasG12D / +; Trp53R172H / +或Trp53loxP / loxP; Pdx1-Cre)和PKT小鼠(LSL-KrasG12D / +; Tgfbr2loxP / loxP; P48-Cre ),在阐明分子和病理机制方面具有重要意义。然而,上述模型无法对基质相关基因的表达进行遗传操作。为了克服这个问题,作者使用了具有双重重组酶系统的小鼠,整合了使用Cre-loxP和Flp-FRT操纵基因的能力。双重重组酶系统允许特定基质相关靶基因的功能性缺失。作者利用该系统删除了在致癌性Kras信号诱导的自发PDAC背景下由特定细胞类型产生的Col1,以揭示Col1在疾病引发和进展中的功能。

(图3,肌成纤维细胞中Col1的缺失显著提高PDAC的恶化进程并降低小鼠存活率)
研究发现,活化的星状细胞/αSMA+肌成纤维细胞是PDAC基质中Col1的主要贡献者。通过使用自发性PDAC的双重重组酶遗传小鼠模型来删除成肌纤维细胞中的Col1,导致基质中Col1含量显著降低,并加速了PanIN(“胰腺上皮内瘤变pancreatic intraepitheliel neoplasia”的简称)和PDAC的出现,从而降低了小鼠的总生存期。 进一步,作者发现Col1缺失通过SOX9导致癌细胞中Cxcl5表达量的上调,而Cxcl5的增加与MDSC(骨髓来源的抑制细胞)的募集和CD8 + T细胞的活性被抑制有关。最后,作者发现可以通过联合靶向CXCR2和CCR2的疗法来缓解该过程,从而抑制基质Col1缺失时PDAC的加速进展。综上,该研究结果揭示了肌成纤维细胞来源的Col1在调节肿瘤免疫力和抑制PDAC进展中的基本作用,并且对未来的PDAC的治疗提供了新的思路。(生物谷 Bioon.com)
原始出处:Yang Chen, Jiha Kim, Sujuan Yang et al., Type I collagen deletion in αSMA+ myofibroblasts augments immune suppression and accelerates progression of pancreatic cancer. Cancer Cell (2021). DOI:https://doi.org/10.1016/j.ccell.2021.02.007
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


