Science子刊:华人学者发现肿瘤通过细胞外囊泡促进T细胞衰老的新机制,为解决癌症免疫治疗耐药带来新思路
来源:生物世界 2025-02-17 09:25
该研究发现,含有 PD-L1 的肿瘤来源的细胞外囊泡(tEV)可驱动人类和小鼠的 T 细胞衰老及免疫抑制。
免疫疗法为癌症患者带来了巨大的希望,但癌症免疫疗法的总体效率仍然有限,许多癌症患者对癌症免疫疗法无反应。肿瘤诱导的免疫抑制是有效的肿瘤免疫治疗的关键障碍之一。
肿瘤细胞能够利用不同的机制来营造独特的免疫抑制性肿瘤微环境(TME),从而促进免疫耐受,这导致了对当前免疫疗法的无反应性。这些机制包括多种共抑制分子的激活和表达增加(例如CTLA-4、PD-1/PD-L的表达);免疫抑制代谢物和细胞因子的分泌(例如乳酸、前列腺素 E2、IL-10、TGF-β等);抗原呈递机制受损;以及肿瘤细胞与免疫细胞竞争营养物质。
此外,肿瘤细胞还会招募并扩增多种调节性细胞群,这些细胞群有助于肿瘤微环境中的免疫抑制网络,包括调节性 T 细胞(Treg)、髓源性抑制细胞(MDSC)、调节性树突状细胞以及衰老 T 细胞。
对这些分子机制以及肿瘤细胞与肿瘤微环境内免疫成分之间相互作用的更深入理解,将有助于开发有效的免疫治疗策略来治疗癌症。
2025年2月12日,圣路易斯大学医学院彭光勇教授团队在 Science 子刊 Science Translational Medicine 上发表了题为:Tumor extracellular vesicle–derived PD-L1 promotes T cell senescence through lipid metabolism reprogramming 的研究论文。
该研究发现,含有 PD-L1 的肿瘤来源的细胞外囊泡(tEV)可驱动人类和小鼠的 T 细胞衰老及免疫抑制。这与脂质代谢的改变以及 CREB 信号传导有关,抑制 tEV 的形成、脂质代谢或 CREB 信号传导,能够逆转 T 细胞衰老,并使肿瘤对 PD-L1 抑制剂治疗更敏感,从而提高癌症免疫治疗效果。
这些结果共同表明,靶向 T 细胞的脂质代谢和衰老状态,能够解决癌症免疫疗法的耐药性问题。

细胞外囊泡(EV)是细胞间通讯的关键介质,在肿瘤免疫学研究中引起了极大关注。在肿瘤微环境(TME)免疫抑制网络的构建过程中,肿瘤细胞通过分泌细胞外囊泡(EV),将生物活性物质转移至邻近和远端部位,以协调促进肿瘤细胞增殖和抑制免疫细胞的多个关键事件。
肿瘤来源的细胞外囊泡(tEV)可通过调节上皮间质转化和细胞外基质重塑,以及促进癌症相关血管生成,为肿瘤的发展和进展创造适宜的环境。此外,tEV 还能够调节多种免疫成分的功能,从而在肿瘤微环境(TME)中实现免疫抑制,包括抑制 T 细胞增殖和效应功能、促进调节性 T 细胞(Treg)或髓源性抑制细胞(MDSC)的扩增。
tEV 中包含多种生物分子,例如脂质、蛋白质、mRNA、非编码 RNA、DNA 以及代谢物,并且 tEV 有助于细胞间通讯。tEV 利用这些成分和分子过程来抑制 T 细胞的抗肿瘤免疫反应。为了开发有效的免疫疗法,需要进一步明确 tEV 中的关键成分及其相关的免疫抑制分子作用。
目前靶向 PD-1、PD-L1 和 CTLA-4 等抑制性分子的免疫检查点阻断疗法,对某些癌症患者的治疗效果令人鼓舞,这些疗法也已成为癌症治疗的一线治疗方案。抗 PD-L1 抗体阿替利珠单抗(atezolizumab)、抗 PD-1 抗体纳武利尤单抗(nivolumab)和帕博利珠单抗(pembrolizumab)已在实体瘤治疗中显示出临床益处。然而,只有少数患者对这些疗法有反应,免疫检查点阻断疗法的整体成功率仍有限,不超过 40%。因此,探究导致肿瘤免疫治疗耐药性的新机制对于改善临床治疗至关重要。
肿瘤来源的细胞外囊泡(tEV)中 PD-L1 的存在与肿瘤进展呈正相关,用抗 PD-L1 抗体阻断细胞外囊泡(EV)中 PD-L1 活性,可促进抗肿瘤免疫并减弱 tEV 介导的 T 细胞抑制。因此,更深入地了解肿瘤微环境中这些抑制性分子的来源及其分子过程,将为预测患者对检查点免疫疗法的反应带来新的见解,并提高治疗效果。
在这项最新研究中,研究团队揭示了肿瘤来源的细胞外囊泡(tEV)能够诱导 T 细胞衰老并抑制其活性。PD-L1 是 tEV 中的关键成分,可诱导人和小鼠 T 细胞发生 DNA 损伤和脂质代谢过度活跃。这导致脂质代谢酶的表达升高,胆固醇和脂滴形成增加,从而引发细胞衰老。
在分子水平上,来自 tEV 的 PD-L1 激活了 cAMP 响应元件结合蛋白(CREB)和信号转导及转录激活因子(STAT)信号通路,这促进了脂质代谢,并促使人和小鼠的 T 细胞衰老。
在肿瘤中抑制细胞外囊泡(EV)的合成或在效应 T 细胞中阻断 CREB 信号传导、胆固醇合成以及脂滴形成,可在体外以及体内(细胞过继转移和黑色素瘤小鼠模型)避免 tEV 介导的 T 细胞衰老。同样的治疗方法还增强了人类和小鼠黑色素瘤模型中过继转移 T 细胞疗法和抗 PD-L1 检查点免疫疗法的抗肿瘤疗效。
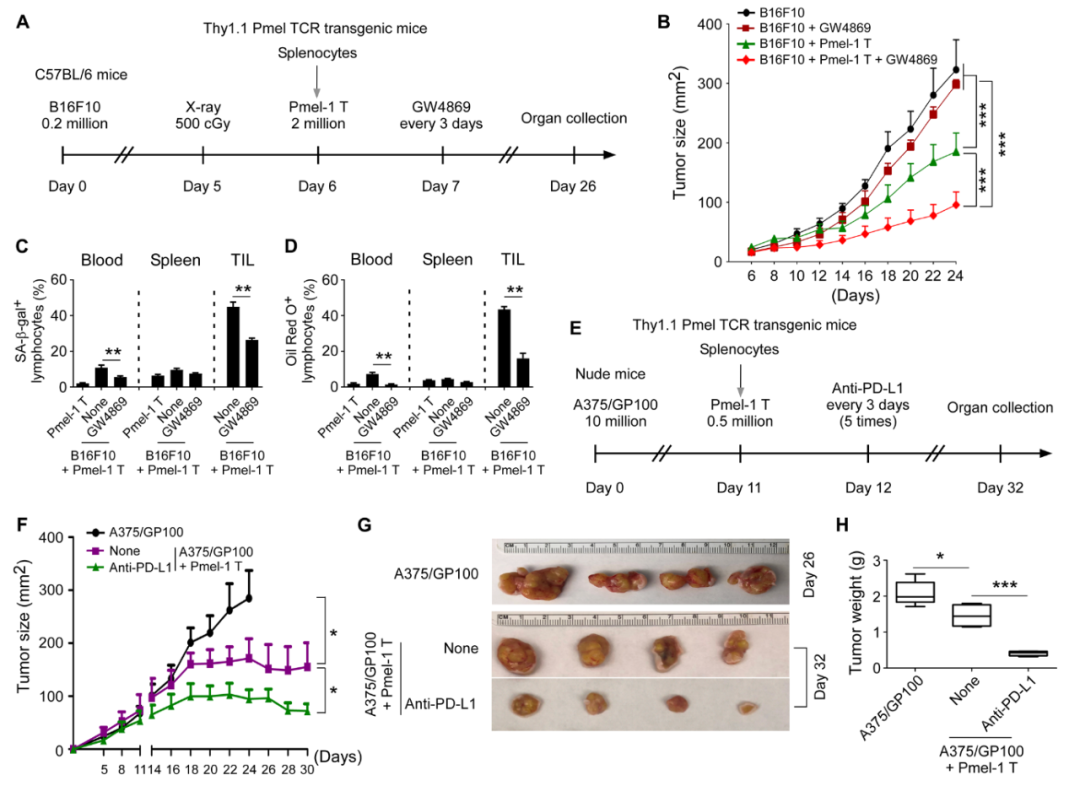
阻断肿瘤细胞产生细胞外囊泡,可防止效应T细胞衰老,增强肿瘤特异性T细胞介导的抗肿瘤功效
这些研究确定了肿瘤介导的免疫抑制与潜在免疫治疗耐药性之间的机制联系,并为癌症免疫治疗提供了新策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


