科学家揭示外源核酸诱导的原核生物短Ago蛋白系统发挥功能的分子机理
来源:网络 2023-10-05 18:46
RNA介导的转录后基因调控在生命个体抵御外源入侵的过程中起到重要作用。Argonaute(Ago)蛋白是存在于古菌、细菌和真核生物中的一种蛋白。它为非编码小RNA提供锚位点,达到降解靶基因或者抑制翻译
RNA介导的转录后基因调控在生命个体抵御外源入侵的过程中起到重要作用。Argonaute(Ago)蛋白是存在于古菌、细菌和真核生物中的一种蛋白。它为非编码小RNA提供锚位点,达到降解靶基因或者抑制翻译的目的。对比真核生物的Ago,原核生物的Ago展现出多样性,分为三个家族——长A型、长B型和短Ago亚型。原核长A和长B型Ago包括四个结构域,即N端结构域、PAZ结构域、MID结构域和PIWI结构域。这四个结构域在Ago蛋白系统发挥功能的过程中发挥重要的功能,缺一不可。原核短Ago不具备N端和PAZ结构域(图1a),因此原核短Ago在发挥功能时必须招募一些其他蛋白如SIR2和TIR蛋白,补偿N端和PAZ结构域的功能。
与真核生物相比,原核生物的Ago不仅可以介导由DNA引导的靶向DNA干扰,而且可以介导由RNA引导的靶向RNA或者DNA干扰。因此,原核生物的Ago展示出更多的功能,如靶向干扰噬菌体入侵和外源质粒DNA扩增、阻碍外源基因组的复制和增强基因的同源重组等。NAD+(烟酰胺腺嘌呤二核苷酸)是细胞生命活动周期中的重要代谢产物,NAD+的耗尽会直接导致真核或者原核生命个体的死亡。原核短Ago作为原核细菌的免疫系统关键蛋白,在识别入侵核酸后会激活NAD+酶的活性,耗尽个体的NAD+,诱导细胞的死亡,从而阻碍外源入侵基因组的复制和扩增,而这背后的结构机理仍然未知。
10月2日,中国科学院物理研究所/北京凝聚态物理国家研究中心丁玮团队和朱洪涛团队,与中国医学科学院和北京协和医学院病原生物研究所崔胜团队合作,在《自然》(Nature)上,发表了题为Nucleic Acid-triggered NADase activation of a short prokaryotic Argonaute的研究论文。该研究通过高分辨冷冻电镜技术与自主研发的自动化结构解析策略,在数百万计的冷冻电镜蛋白质颗粒中,高效地筛选并重构了与五个与原核短Ago系统相关的高分辨率三维结构——自抑制的功能单元单体、载有引导RNA/靶向DNA的功能单元单体、两个不同构象的功能单元的二聚体和功能单元的四聚体(图1b-c)。
研究以此结构为基础结合体外功能实验发现,在存在外源DNA的情况下,原核短Ago系统功能单元单体会从入侵基因的转录组中获得引导RNA片段。该引导RNA片段会与原核短Ago系统结合,并进一步通过碱基配对识别与引导RNA序列互补的目标DNA(图1b-c)。在此过程中,引导RNA可能从它在MID结构域中的结合位点上解离,以便引导RNA与靶向DNA的杂交双链的形成。杂交双链的形成会导致原核短Ago系统的构象发生变化,并通过MID结构域形成二聚体(图1c)。而在形成二聚体的过程中,一个功能单元的TIR结构域会发生翻转,且与另一个功能单元的TIR相互作用,使得两个TIR结构域以头尾相接的形式组织在一起,并在作用界面上形成一个完整的NADase活性位点(图1d)。两个二聚体会进一步通过它们的TIR结构域形成一个四聚体(图1e)。四聚体形式的组装体会发挥NADase的作用,耗尽细胞内的NAD+,导致细胞本身的死亡,阻碍了外源基因的扩增。
该研究为剖析原核短Ago系统如何发挥功能奠定了重要的结构基础,并揭示了原核短Ago中NADase的激活机制以及导致细菌死亡的分子机理。
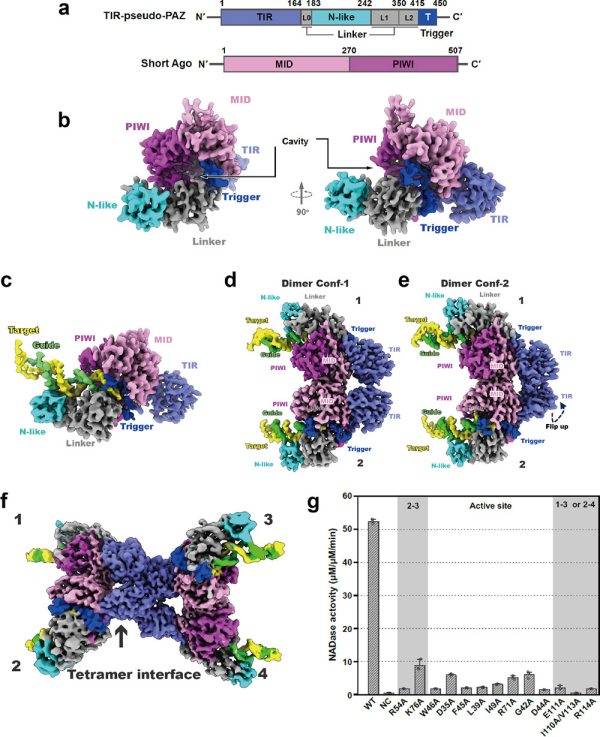
图1. 原核短Ago的三维高分辨结构
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


