Nature子刊:马光辉/魏炜/田志远团队开发光控全肿瘤细胞疫苗
来源:生物世界 2023-08-03 17:48
全肿瘤细胞疫苗(whole tumor cell vaccine,TCV)是经典的个体化肿瘤免疫疗法,但TCV免疫原性弱且引起的免疫反应个体差异大,亟需通过学科交叉发展新理念和新技术,实现TCV的按需
全肿瘤细胞疫苗(whole tumor cell vaccine,TCV)是经典的个体化肿瘤免疫疗法,但TCV免疫原性弱且引起的免疫反应个体差异大,亟需通过学科交叉发展新理念和新技术,实现TCV的按需免疫增效。
长期以来,肿瘤疫苗被认为是一种有前景的癌症免疫治疗方式,因为它利用了人体的免疫系统来对抗肿瘤细胞。在肿瘤疫苗中,全肿瘤细胞疫苗(whole tumor cell vaccine,TCV)非常独特,因为它们包含了患者自身肿瘤细胞中的所有潜在抗原,而不仅仅是一个或一组。因此,TCV可能更容易诱导患者的免疫反应,它们比普通肿瘤疫苗对更广泛的抗原产生反应。
但TCV免疫原性弱且引起的免疫反应个体差异大,为了提高七其作为疫苗的免疫原性,科学家们一直在探索佐剂相关方法,但这些方法通常复杂且耗时。TCV的面临的另一个挑战是需要多次接种来维持免疫反应,而患者的肿瘤样本较为珍贵,使得疫苗的制备和存储存在较大困难,且难以针对患者设计个性化治疗方案。
针对这些挑战,研究人员一直希望能开发出有效的单剂量TCV,以便按需增强免疫反应,以匹配个体患者的异质性免疫反应。
近日,中国科学院过程工程所生化工程国家重点实验室马光辉院士、魏炜研究员,联合中国科学院大学化学科学学院田志远教授,在 Nature Communications 期刊发表了题为:Generation of whole tumor cell vaccine for on-demand manipulation of immune responses against cancer under near-infrared laser irradiation 的研究论文。
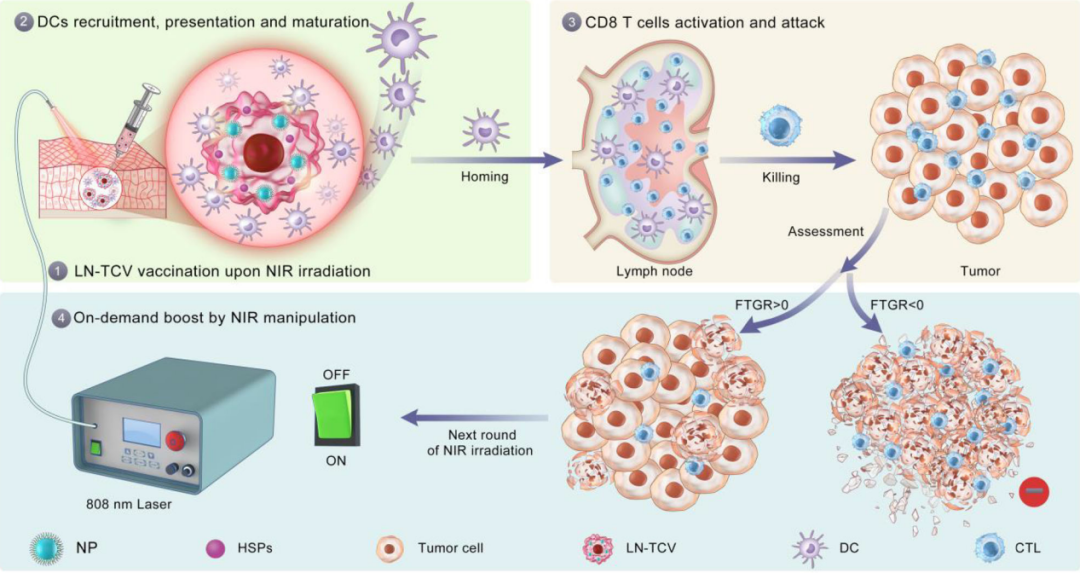
该研究开发了一种灵活有效的“按需”全肿瘤细胞疫苗(TCV)设计,将具有光热效应的纳米颗粒负载于肿瘤细胞中,通过近红外光照诱导肿瘤细胞产生内源性免疫佐剂热休克蛋白,反复冻融后形成光控型全肿瘤细胞疫苗(LN-TCV)。该疫苗依据肿瘤进展情况在接种部位按需实施无创、易于操作的近红外(NIR)光照,以此实现最佳的脉冲免疫增效。

在制备TCV疫苗的过程中,研究团队首先将光热纳米颗粒装载到肿瘤细胞中。随后,近红外激光照射诱导肿瘤细胞过表达热休克蛋白(HSP)作为内源性佐剂。然后在制备TCV疫苗之前,通过冻融过程将肿瘤细胞灭活,从而制备出光控型全肿瘤细胞疫苗(LN-TCV)。
在单次接种免疫后,研究团队在接种部位应用近红外激光照射,从而产生局部诱导的温和的炎症反应。这促进了树突状细胞的募集、激活和呈递,然后激活淋巴结中的T细胞,进行后续的肿瘤细胞杀伤。田志远教授表示,非常低功率的近红外光照射就可以产生足够的局部热疗来促进这种炎症过程。
上述LN-TCV在多种细胞来源(包括三阴性乳腺癌、结肠癌、肺癌和胰腺癌)的肿瘤异种移植模型(CDX)以及人源化的胰腺癌患者来源肿瘤异种移植模型(PDX)中展现出显著的治疗效果,证明了“光控免疫”的新理念在肿瘤疫苗中的先进性和优越性。
近红外照射调控全肿瘤细胞疫苗免疫反应的作用机制
马光辉院士表示,为了监测肿瘤生长速率,该研究还提出了一个指标——肿瘤生长速率波动(FTGR),FTGR可以通过在接种部位重复的近红外激光照射,为合理的按需增强免疫反应提供标准,使得脉冲增效能够精准契合肿瘤的发展进程。
魏炜研究员表示,这种按需TCV策略显示出良好的灵活性和强大的治疗效果,尽管目前处于临床前研究阶段,但它在未来的临床应用中具有巨大潜力。未来还可以通过可穿戴贴片式LED和远程控制系统扩展临床适用场景,实现更加便捷和高效的个体化治疗。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


