Hepatology:浙江大学徐骁团队揭示肝癌免疫治疗失效关键机制
来源:浙江大学医学院 2023-01-02 12:49
研究团队通过机器学习的方法从大样本肝癌蛋白质组学数据中发现了肝癌浸润T细胞中高表达的一种淋巴细胞迁移相关激酶:胞质分裂蛋白2(DOCK2)。
肝细胞癌(HCC)是最常见的原发性肝肿瘤,是全球癌症相关死亡的主要原因之一,主要与乙型或丙型肝炎病毒感染、酗酒和代谢综合征有关。多种酪氨酸激酶抑制剂(TKI)已被用作临床一线或二线治疗晚期肝癌,但其延长患者生存期的疗效有限,这是由于肝脏表现为免疫抑制性微环境,对外来因素容易产生耐受性。另一方面,肝癌中肿瘤相关巨噬细胞(TAM)的富集和肿瘤浸润淋巴细胞(TIL)的耗竭会促使 HCC 患者的适应性免疫反应减弱。
免疫检查点,包括CTLA-4和PD-1可防止效应淋巴细胞过度激活。PD-1抑制剂纳武单抗已获得美国FDA的加速批准,用于治疗先前接受过索拉非尼治疗的晚期肝癌患者。然而,许多肝癌患者仍然不能从免疫治疗中受益。从机制上讲,抗原呈递失败、抑制性免疫微环境、免疫检查点分子和免疫抑制细胞的改变都是免疫治疗失败的潜在因素。进一步挖掘肝癌免疫治疗失效的关键性事件,对于改善免疫治疗效果具有极大的作用。
近日,浙江大学医学院徐骁教授团队在国际肝脏病学权威期刊 Hepatology 上发表了题为:SULT2B1-CS-DOCK2 Axis Regulates Effector T Cell Exhaustion in Hepatocellular Carcinoma Microenvironment 的研究论文。
研究团队通过机器学习的方法从大样本肝癌蛋白质组学数据中发现了肝癌浸润T细胞中高表达的一种淋巴细胞迁移相关激酶:胞质分裂蛋白2(DOCK2)。其对效应T细胞浸润和抗癌功能至关重要。而高表达磺基转移酶2B1(SULT2B1)的肿瘤细胞会释放胆固醇硫酸盐,抑制DOCK2酶活性,破坏效应T细胞的线粒体稳态,促使效应T细胞的功能耗竭,让肿瘤细胞获得对免疫治疗的抵抗力,加速肝癌进展。
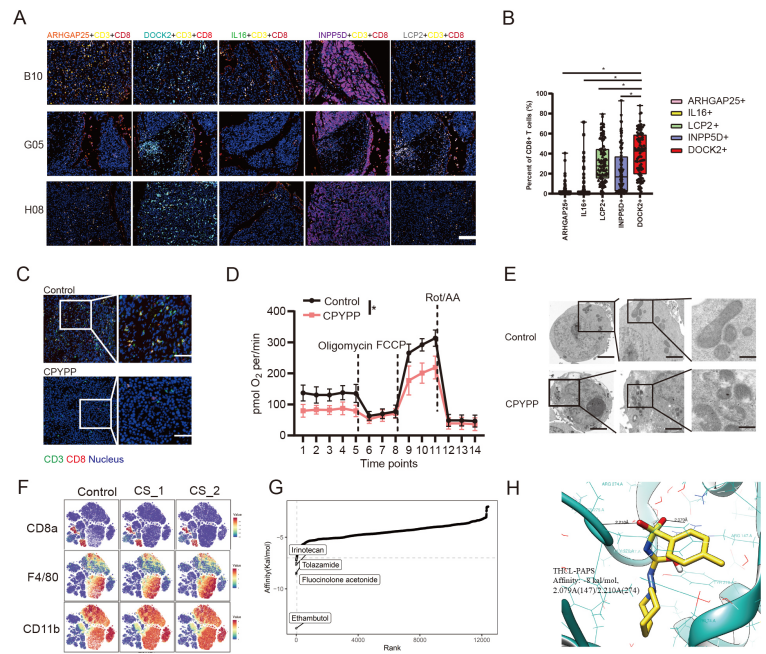
图 1. A-B,肝癌组织芯片分析显示 DOCK2 阳性 CD8+T 细胞比例最高。C,DOCK2 抑制剂 CPYPP 处理的 Hepa1-6 原位移植瘤模型中 T 细胞浸润减少。D,CPYPP 抑制 CD8+T 细胞线粒体代谢。E,CPYPP 促进 CD8+T 细胞中线粒体空泡产生。F,胆固醇硫酸盐 CS 减少 CD8+T 细胞浸润,促进髓系抑制性细胞浸润。G,虚拟筛选显示小分子与 SULT2B1 的亲和力排序。H,分子对接显示 THCL 与 SULT2B1 存在较强结合。
为了减弱肝癌对免疫治疗的抵抗,逆转HCC微环境中效应T细胞的功能耗竭,恢复DOCK2介导效应T细胞的迁移与杀伤能力,项目组发掘了一些小分子药物,如伊立替康 (CPT-11)或妥拉璜脲(THCL)能够通过抑制SULT2B1介导的CS释放来恢复效应T细胞杀伤能力,增强免疫治疗效果。
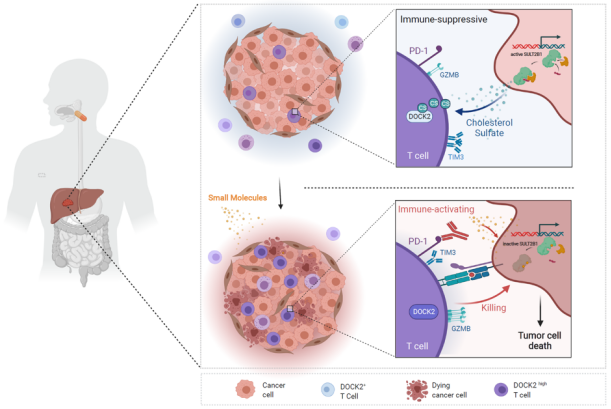
图2. 肝癌细胞高表达 SULT2B1,催化胆固醇硫酸盐产生,抑制肿瘤浸润 T 细胞 DOCK2 酶活性,促进 T 细胞耗竭;外源小分子药物摄入,可以失活 SULT2B1,恢复肝癌浸润 T 细胞的杀伤能力。
论文通讯作者是浙江大学医学院徐骁教授和浙江大学医学院附属杭州市一医院肝胆胰外科鲁迪副主任医师。论文第一作者是附属杭州市一医院特聘副研究员、浙江省肿瘤融合研究与智能医学重点实验室 PI 王帅博士,浙江大学医学院博士研究生王睿、硕士研究生许楠为共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


