Science:西湖大学李晓波团队发现海洋光合作用关键色素合成酶
来源:生物世界 2023-10-08 09:12
下一步,李小波团队将致力于解析硅藻含叶绿素c的捕光色素-蛋白复合体生物合成所需的全部基因,并将试图在其他光合生物中重构该复合体,以拓宽该底盘生物的捕光光谱。
西湖大学生命科学学院李小波团队在国际顶尖学术期刊 Science 发表了题为:A chlorophyll c synthase widely co-opted by phytoplankton 的研究论文。
该研究首次揭示了叶绿素c合成酶编码基因及该酶作用机制,挖掘了叶绿素c的生理功能,讨论了该基因的演化形成与转移。
叶绿素c于1864年由爱尔兰物理学家乔治·斯托克斯首次报道,其合成酶的发现解决了长期以来困扰海洋光合作用领域的一个问题,并为海洋藻类捕光机制的合成生物学应用打开了一扇门。

传奇:从硅藻到叶绿素c
苏轼在《前赤壁赋》中写道:“寄蜉蝣于天地,渺沧海之一粟。”如果你拿出一滴海水放在显微镜中,你会看到一个生机勃勃的微观世界。硅藻,就是仿佛如此微不足道,却在海洋光合作用中起主导地位的生存强者。
硅藻作为单细胞真核生物,一般只有2微米到200微米,只有少数门类可以达到毫米级,所以在18世纪之前,人们甚至都不知道它们的存在。但硅藻的演化之路绝对是史诗级的——二次内共生。
目前主流理论认为,一个异养生命通过吞噬蓝细菌获得了光合作用的能力,演化出了绿藻与红藻,蓝细菌演化成了叶绿体,这是人们常知的第一次内共生。而硅藻的祖先,是不折不扣凶悍的掠食者,它们吞噬了已经具备细胞核与叶绿体的红藻,并获取了特定的红藻基因,这也被称为第二次内共生。
硅藻绝对是演化史中的“卷王”,也许是为了防御,硅藻还演化出了厚实的“装甲”——它们学会了利用二氧化硅,没错,你可以理解成它们给自己装上了颇为现代化的玻璃外壳。很多硅藻可以在有性生殖和无性生殖之间切换:平时进行无性生殖,然而由于其奇特的增殖方式,子代细胞会越来越小;在细胞小于一定阈值时这些硅藻则启动有性生殖。硅藻的祖先中有一支又另辟蹊径,演化出了多细胞的藻类,演化出巨大体型的褐藻,比如我们日常食用的海带。
正因为如此,李小波此前主要在国外从事莱茵衣藻光合作用的研究,但加入西湖大学之后逐渐认识到硅藻的独特性,决定将硅藻光合作用作为实验室一个重要的研究方向。李小波团队将目光投射到硅藻的捕光机制上,含有叶绿素c的捕光复合体的吸收光谱不同于陆地植物的捕光复合体,可以更高效地吸收水域中丰富的蓝绿光,这可能是各种真核藻类广泛采用叶绿素c的原因。
光合作用极其复杂,人类目前还不能完全解密,就叶绿素的种类与合成研究来说,也是走过了一段漫长的弯路。目前认为产氧光合生物主要含有五种类型的叶绿素:叶绿素a, b, c, d, f,其结构与合成路径各有不同。
与其他天然产物一样,叶绿素生物合成的每一步骤依赖于酶的催化,而每个酶有一个或多个基因编码。每种叶绿素生物合成通路的解析将使得该叶绿素在其他物种中的应用成为可能。
李小波团队开始了寻找叶绿素c合成酶的道路。
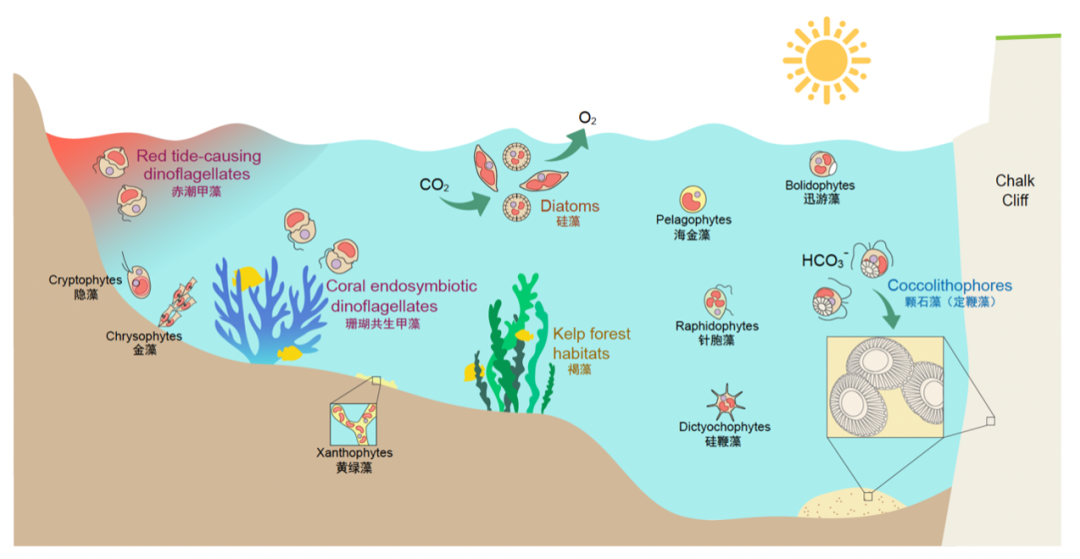
含叶绿素c藻类的多样性与生态功能示意图。作者:李小波实验室博士生杨雨青
挑战:锁定基因
得益于世纪之交分子遗传学工具的大发展,各种叶绿素生物合成的共有步骤或特异步骤所需基因已被发现。例如,蓝细菌叶绿素f于2010年被报道,其合成酶编码基因于2016年即已被解析。而叶绿素c发现于159年前,它的合成酶编码基因则长期以来未被突破。
为什么叶绿素c合成机制的研究这么难?
在真核藻类中,绿藻中的莱茵衣藻遗传学研究较多,然而绿藻不含有叶绿素c。硅藻、褐藻、定鞭藻、甲藻等含叶绿素c的门类在海洋固碳、海洋动物生存及栖息地的建立、海洋沉积物以及赤潮的形成等重要生态过程中扮演着不可或缺的角色,其中的海带(褐藻)还是人类喜爱的食物来源。然而这些藻类的遗传操作工具却相对落后。
硅藻类群中的模式物种三角褐指藻早在2008年就已完成基因组测序,但是由于硅藻细胞一般为二倍体,即每个细胞具有两套基因组,传统遗传学手段很难同时破坏基因的两个拷贝以测试其功能。但好消息是,近年来CRISPR基因编辑方法(2020年诺贝尔化学奖获奖成果)的进步使得一个基因的两个拷贝同时被破坏成为可能。
为了找到编码叶绿素c合成酶的基因,李小波团队从三角褐指藻基因组中根据各基因在不同生长条件下的表达水平差异,选取了数十个候选基因,依次进行敲除与表型检测。
其中一个候选基因的敲除突变体呈现出绿色表型,与野生型硅藻细胞的褐色外观形成鲜明对比。色素分析显示,该基因的突变体完全丢失了叶绿素c,同时,突变体中岩藻黄素(与叶绿素c处于同一色素-蛋白复合体的黄色色素)的含量显著降低,因此突变体呈现出比野生型更绿的颜色。在低光照条件下,该突变体表现出明显的生长劣势。
体外实验证实该基因编码的酶能够利用叶绿素生物合成途径中的常见前体直接合成叶绿素c,因此被命名为叶绿素c合成酶(Chl c synthase),简称CHLC。该酶与其他叶绿素合成通路组分的底物特异性可以解释叶绿素c结构的独特之处。
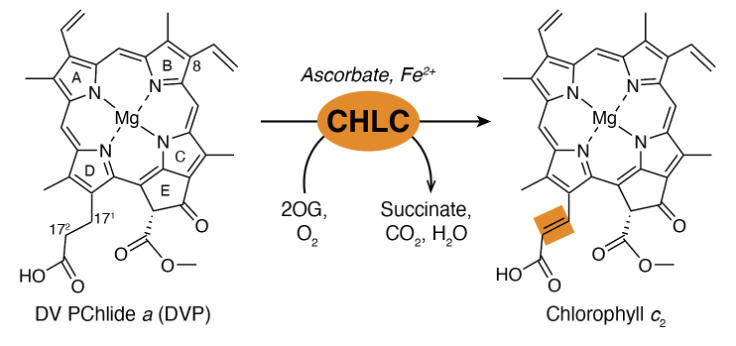
叶绿素c合成反应示意图。CHLC蛋白利用一系列辅因子在底物(DVP)侧链上形成碳碳双键
尾声:这意味着什么?
“这是一篇非常有趣的文章,首次记录了一种对当代水生生物光合作用至关重要的酶的活性和物种分布。文章所描述的叶绿素c合成酶的基因突变、突变体回补和生化活性研究令人信服。”审稿人对李小波团队的成果评价道。
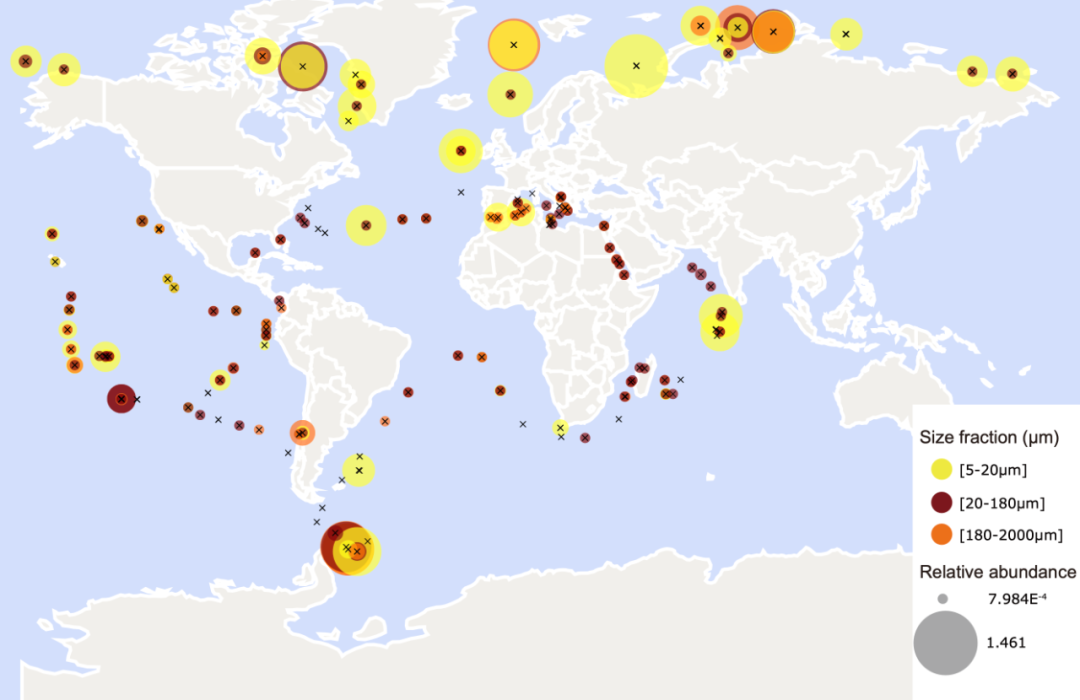
叶绿素c合成酶编码基因同源基因的海洋分布示意图。Tara Oceans各采样站点均可发现同源基因
结合Tara Oceans全球海洋生物调查数据,研究团队发现CHLC同源基因广泛分布于全球海洋。在系统演化分析中,团队发现不含叶绿素c的生物(包括红藻)缺乏CHLC同源基因;而含有叶绿素c的定鞭藻、甲藻和隐藻均具有该基因。然而,与硅藻亲缘关系更近、同样含有叶绿素c的褐藻却缺乏该基因,这表明褐藻可能采用未知的、独立演化出的酶来合成叶绿素c。这一结果也表明现在的光合作用机制演化学说还有待修正。
下一步,李小波团队将致力于解析硅藻含叶绿素c的捕光色素-蛋白复合体生物合成所需的全部基因,并将试图在其他光合生物中重构该复合体,以拓宽该底盘生物的捕光光谱。此外,在光合生物中,海洋藻类的分子遗传学研究远滞后于陆地植物,然而它们却具有多种独特的生物过程,如无机细胞壁纳米斑图的形成。因此,李小波团队一直为寻找海洋藻类宏观和微观现象的分子生物学解释而努力。

李小波实验室成员合影
西湖大学博士生蒋彦酉与助理研究员曹天骏为论文共同第一作者;副研究员张欢、博士生杨雨青、博士生张静宇参与了本项研究;李小波为论文通讯作者。项目的进行得到了西湖大学张骊駻研究员、西湖大学甄莹研究员、中科院植物所王文达研究员、南京大学赵雪博士等的建议,并得到了西湖大学分子科学公共实验平台、西湖大学生物医学实验技术中心等的技术支持。西湖大学博士生尤婷婷、博士生毛卓、博士生刘润洲、科研助理郭康宁、科研助理杨津在实验过程或论文写作过程中提供了帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


