Adv Sci:李杰/郭剑平/王坤团队提出基于铜死亡的三阴性乳腺癌治疗新策略
来源:生物世界 2025-03-06 09:39
这项研究揭示了三阴性乳腺癌(TNBC)抵抗铜死亡耐药的关键机制,并为 TNBC 提出了潜在的治疗策略。
众所周知,多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、坏死性凋亡(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
2012年,哥伦比亚大学的 Brent Stockwell 团队在 Cell 期刊发表论文,发现并定义了一种铁依赖性的新型细胞程序性死亡方式——铁死亡(Ferroptosis),由过度堆积的过氧化脂质(peroxidized lipids)诱导发生。
和铁一样,铜也是从细菌和真菌到植物、动物以及人类生命活动的基本元素,作为必须酶的辅助因子,在生命活动中发挥着必不可少的作用。铜在人体中是一种微量元素,细胞内铜离子的浓度通过主动稳态机制保持在非常低的水平,一旦超过阈值,铜就会变得有毒,导致细胞死亡。
2022年,哈佛-MIT博德研究所 Todd Golub 教授在 Science 期刊发表论文。发现并证实铜依赖性受控细胞死亡方式是一种不同于已知细胞死亡机制的新型细胞死亡方式——铜死亡(Cuprotosis)。
作为一种新型受控细胞死亡方式,诱导肿瘤细胞铜死亡已成为一种有前景的肿瘤治疗策略。
近日,广州医科大学附属妇女儿童医疗中心李杰教授、中山大学附属第一医院郭剑平研究员、广东省人民医院王坤教授作为共同通讯作者,在 Advanced Science 期刊发表了题为:AKT1 Phosphorylates FDX1 to Promote Cuproptosis Resistance in Triple-negative Breast Cancer 的研究论文。
该研究发现,AKT1 通过磷酸化修饰 FDX1,促进了三阴性乳腺癌对铜死亡的抵抗,而AKT1 抑制剂和铜离子载体联合使用,能够协同缓解三阴性乳腺癌的肿瘤发生,这些发现为三阴性乳腺癌的治疗带来了有前景的新策略。

铜死亡(Cuprotosis)是最近定义的一种铜依赖的新型细胞程序性死亡方式,其在肿瘤治疗中,尤其是在乳腺癌中的作用,尚未得到深入探索。
在这项新研究中,研究团队证实,三阴性乳腺癌(TNBC)具有相对较高的铜含量,并表现出对铜死亡的抗性。
从机制上来说,铜激活了 AKT 信号通路,该通路抑制了铁氧还蛋白-1(FDX1),而 FDX1 是铜死亡的关键调控因子。AKT1 介导的 FDX1 磷酸化(FDX1 第 63 位氨基酸的磷酸化)不仅抑制了 FDX1 引起的铜死亡和有氧呼吸,还促进了糖酵解。
在这些发现的基础上,研究团队进一步证实,AKT1 抑制剂与铜离子载体的联合使用,在体外和体内均能协同缓解三阴性乳腺癌的肿瘤发生。
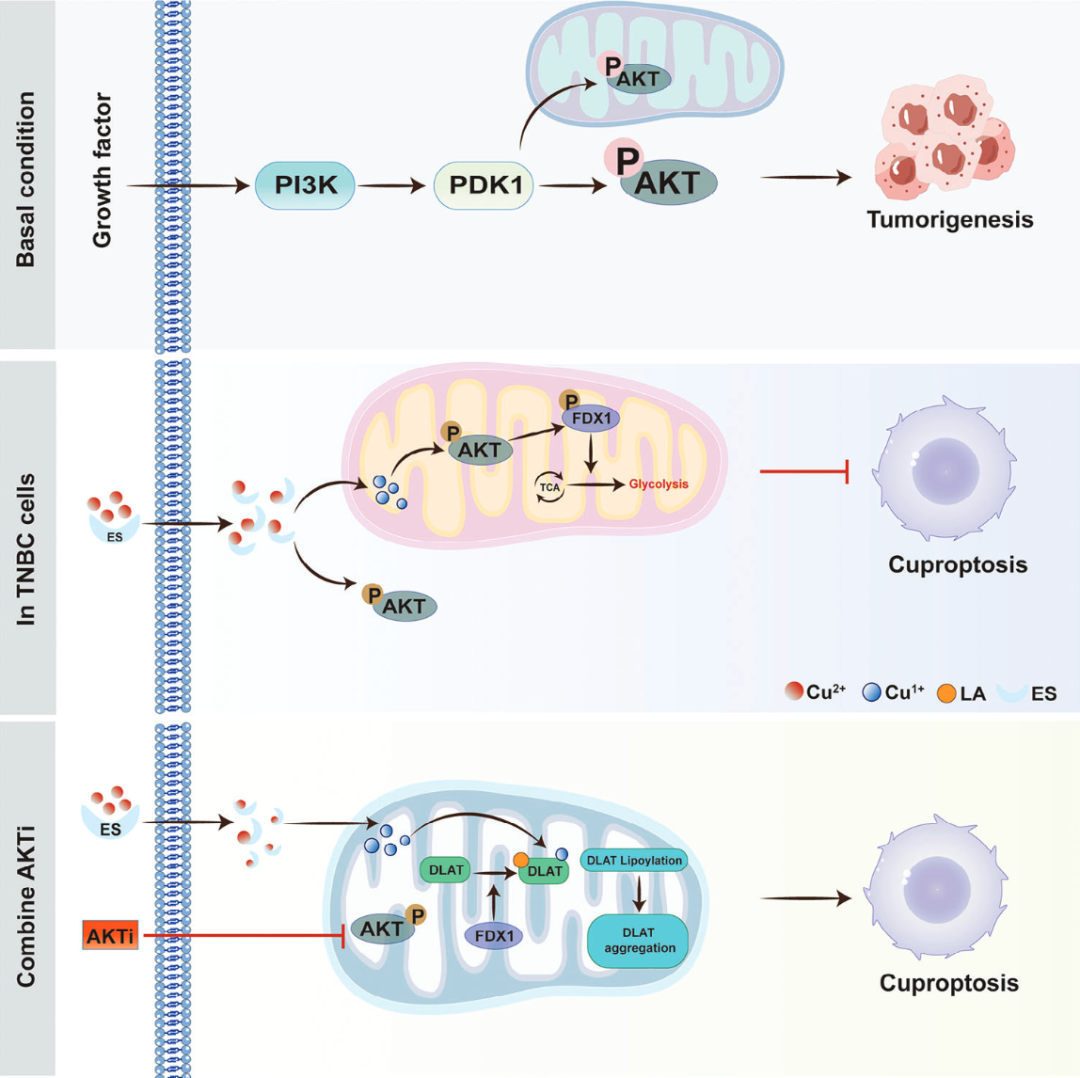
总的来说,这项研究揭示了三阴性乳腺癌(TNBC)抵抗铜死亡耐药的关键机制,并为 TNBC 提出了潜在的治疗策略。
广州医科大学附属妇女儿童医疗中心孙梓乘博士、许华珍研究助理、广西右江民族医学院卢冠铭教授、广东省人民医院杨辞秋博士为论文共同第一作者,广州医科大学附属妇女儿童医疗中心李杰教授、中山大学附属第一医院郭剑平研究员、广东省人民医院王坤教授为论文共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


